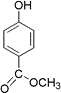
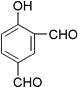
题目内容
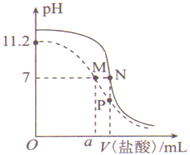
【题目】有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大。A元素原子最外层电子数是次外层电子数的2倍,B元素原子最外层电子数等于其电子层数,且为C元素原子最外层电子数的一半。甲为含B的钠盐,乙为C的最高价氧化物对应的水化物,丙为含A的钠盐。 甲、乙、丙、丁四种物质之间的相互反应关系如下图:
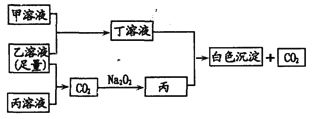
请回答:
(1)写出Na2O2的电子式___________;C在周期表中的位置____________。
(2)用有关化学用语解释丙溶液呈碱性的原因___________________________。
(3)写出甲溶液与足量乙溶液反应的离子方程式: ________________________。
(4)丙和丁因发生双水解而不能共存写出该反应的离子方程式:_____________。
【答案】![]() 第三周期 ⅥA族 CO32-+H2O
第三周期 ⅥA族 CO32-+H2O![]() HCO3-+OH- 4H++AlO2―= Al3++2H2O 2Al3++3CO32-+3H2O= 2Al(OH)3↓+3 CO2↑
HCO3-+OH- 4H++AlO2―= Al3++2H2O 2Al3++3CO32-+3H2O= 2Al(OH)3↓+3 CO2↑
【解析】
A元素原子最外层电子数是次外层电子数的2倍,即A为C,B元素最外层电子数等于其电子层数,三种元素原子序数依次增大,则B为Al,Al的最外层电子式为C原子最外层电子数一半,则C为S,甲为含B的钠盐,即甲为NaAlO2,乙为C的最高价氧化物对应的水化物,则C为H2SO4,丙为含A的钠盐,丙可能为Na2CO3或NaHCO3,然后根据转化关系进行分析即可。
A元素原子最外层电子数是次外层电子数的2倍,即A为C,B元素最外层电子数等于其电子层数,三种元素原子序数依次增大,则B为Al,Al的最外层电子式为C原子最外层电子数一半,则C为S,甲为含B的钠盐,即甲为NaAlO2,乙为C的最高价氧化物对应的水化物,则C为H2SO4,丙为含A的钠盐,丙可能为Na2CO3或NaHCO3,根据转化关系CO2与Na2O2反应生成丙,即丙为Na2CO3,(1)过氧化钠的电子式为![]() ;C为S,位于第三周期VIA族;(2)根据上述分析,丙为Na2CO3,属于强碱弱酸盐,溶液显碱性,是因为CO32-的水解造成, CO32-+H2O
;C为S,位于第三周期VIA族;(2)根据上述分析,丙为Na2CO3,属于强碱弱酸盐,溶液显碱性,是因为CO32-的水解造成, CO32-+H2O![]() HCO3-+OH-;(3)氢氧化铝为两性氢氧化物,NaAlO2溶液中加入过量的H2SO4,离子反应方程式为AlO2-+4H+=Al3++2H2O;(4)根据上述分析,丁溶液为Al2(SO4)3,Al3+和CO32-发生双水解反应,其离子反应方程式为2Al3++3CO32-+3H2O= 2Al(OH)3↓+3CO2↑。
HCO3-+OH-;(3)氢氧化铝为两性氢氧化物,NaAlO2溶液中加入过量的H2SO4,离子反应方程式为AlO2-+4H+=Al3++2H2O;(4)根据上述分析,丁溶液为Al2(SO4)3,Al3+和CO32-发生双水解反应,其离子反应方程式为2Al3++3CO32-+3H2O= 2Al(OH)3↓+3CO2↑。