题目内容
某澄清透明溶液中可能含有:NH4+、Ba2+、Al3+、Fe2+、SO32-、SO42-、HCO3- 中的几种离子。为确定溶液组成,进行如下实验:
①测定溶液的pH,溶液显强酸性。滴加Ba(NO3)2(aq)出现白色沉淀。
②取少量溶液加入NaOH(aq)至强碱性,产生刺激性气味的气体并得到澄清溶液。
③在②的澄清溶液中通入足量CO2,有白色沉淀生成。 由此,正确的推测是
①测定溶液的pH,溶液显强酸性。滴加Ba(NO3)2(aq)出现白色沉淀。
②取少量溶液加入NaOH(aq)至强碱性,产生刺激性气味的气体并得到澄清溶液。
③在②的澄清溶液中通入足量CO2,有白色沉淀生成。 由此,正确的推测是
| A.一定有Al3+离子 | B.可能有HCO3-离子 |
| C.不能确定SO32-离子是否存在 | D.不存在Fe2+离子,可能存在Ba2+离子 |
A
①测定溶液的pH,溶液显强酸性,则溶液中不存在弱酸性离子SO32-、HCO3-,B、C错误;
滴加Ba(NO3)2(aq)出现白色沉淀,溶液中一定含SO42-,而SO42-不能与Ba2+共存,D错误;
由②可知,溶液中不含Fe2+,一定有NH4+,可能有Al3+;
由③可知,溶液中一定有Al3+,A正确;②、③的反应式如下:
Al3+ + 4OH- → AlO2- + 2H2O;
2AlO2-+ CO2+ 3H2O →2Al(OH)3↓+CO3-
滴加Ba(NO3)2(aq)出现白色沉淀,溶液中一定含SO42-,而SO42-不能与Ba2+共存,D错误;
由②可知,溶液中不含Fe2+,一定有NH4+,可能有Al3+;
由③可知,溶液中一定有Al3+,A正确;②、③的反应式如下:
Al3+ + 4OH- → AlO2- + 2H2O;
2AlO2-+ CO2+ 3H2O →2Al(OH)3↓+CO3-

练习册系列答案
相关题目
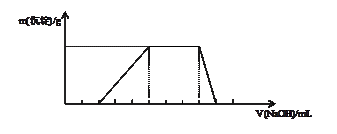
 l2的混合溶液来检验
l2的混合溶液来检验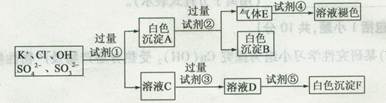
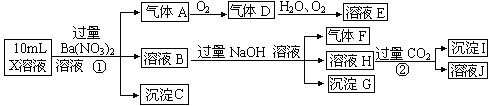
 +3H2O。下列叙述正确的是
+3H2O。下列叙述正确的是 沉淀产生;
沉淀产生;