题目内容
【题目】钢铁工业是国民经济的重要基础产业,目前比较先进的天然气竖炉冶铁工艺流程如下图所示:
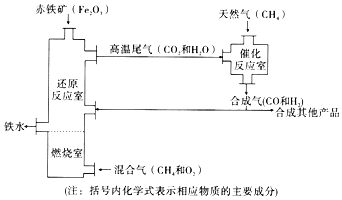
(1)催化反应室发生的反应为:
ⅰ.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=+206kJ/mol
CO(g)+3H2(g) △H=+206kJ/mol
ⅱ.CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+247kJ/mol。
2CO(g)+2H2(g) △H=+247kJ/mol。
① 催化反应室可能发生的副反应有CH4(g)+2H2O(g)![]() CO2(g)+4H2(g),则该反应的△H=____。
CO2(g)+4H2(g),则该反应的△H=____。
② 催化反应室的温度通常需维持在550~750℃之间,从化学反应速率角度考虑,其主要目的是________。
③ 在催化反应室中,若两反应达到平衡时,容器中n(CH4)=0.2mol,n(CO)=0.3mol,n(H2)=0.5mol,则通入催化反应室CH4的起始物质的量为______mol(不考虑副反应)。
(2)还原反应室发生的反应为:
ⅰ.Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H=-25kJ/mol
2Fe(s)+3CO2(g) △H=-25kJ/mol
ⅱ.Fe2O3(s)+3H2(g)![]() 2Fe(s)+3H2O(g) △H=+98kJ/mol
2Fe(s)+3H2O(g) △H=+98kJ/mol
① 下列措施中能使反应i平衡时![]() 增大的是______(填字母)。
增大的是______(填字母)。
A.增大压强 B.降低温度 C.充入一定量氮气 D.增加Fe2O3(s)用量
E.增大CO的浓度 F.加入合适的催化剂
②若在1000℃下进行反应1(该温度下化学反应平衡常数为64), CO起始浓度为量2mol/L(Fe2O3过量),则CO的转化率为_______。
③天然气竖炉冶铁相对于传统焦炭冶铁,该冶铁工艺的优点是_________。
(3)铁钛合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程发生的反应有:①2Fe3++Fe=3Fe2+
②Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
③________________。
【答案】 +165kJ/mol 一定温度范围内,催化剂的活性越大,维持反应速率较快(合理即给分) 0.4mol B 80% 生成的部分CO2及水蒸气可循环利用;该工艺中较大比例的H2作还原剂,可减少CO2的排放(只要答一点即可) 2TiO2++Fe+4H+=2Ti3++Fe2++2H2O
【解析】(1)①考查热化学反应方程式的计算,利用盖斯定律进行判断,即有i×2-ii,得出△H=(206×2-247)kJ·mol-1=+165kJ·mol-1;②考查催化剂的催化效率,在一定温度范围内催化剂的活性最大,化学反应速率加快;③本题考查化学平衡的计算,CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
变化量:x x x 3x
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
变化量:y y 2y 2y
则有:x+2y=0.3,3x+2y=0.5,解得x=y=0.1mol,则起始时通入甲烷的量(0.1+0.1+0.2)mol=0.4mol;(2)①考查影响化学平衡移动的因素,A、增大压强,平衡不移动,比值不变,故A错误;B、正反应是放热反应,降低温度,平衡向正反应方向移动,即c(CO2)增大,c(CO)减小,因此比值增大,故B正确;C、因为反应前后气体系数之和相同,通入非反应气体,化学平衡不移动,即比值不变,故C错误;D、氧化铁是固体,浓度视为常数,增加氧化铁的量,平衡不移动,即比值不变,故D错误;E、根据化学平衡常数K=c3(CO2)/c3(CO),温度不变化学平衡常数不变,即通入CO2,比值不变,故E错误;F、使用催化剂,对化学平衡移动没有影响,即比值不变,故F错误;②考查化学平衡的计算,令达到平衡时,CO的浓度为amol·L-1,根据平衡常数的表达式,K=(2-a)3/a3=64,解得a=0.4mol·L-1,则消耗CO的物质的量浓度为(2-0.4)mol·L-1=1.6mol·L-1,其转化率为1.6/2×100%=80%;③考查流程的优点,生成的部分CO2及水蒸气可循环利用;该工艺中较大比例的H2作还原剂,可减少CO2的排放;(3)③加入铁屑至溶液出现紫色,说明溶液中Ti元素以Ti3+形式的存在,假如铁屑,把TiO2+中Ti还原成Ti3+,根据信息①,铁元素以Fe2+形式存在,因为溶液显酸性,因此离子反应方程式为2TiO2++Fe+4H+=2Ti3++Fe2++2H2O。

 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案【题目】CO2的转换在生产、生活中具有重要的应用。
(1)CO2的低碳转型对抵御气候变化具有重要意义,海洋是地球上碳元素最大的“吸收池”。
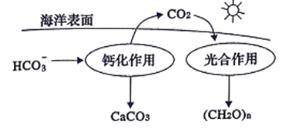
①溶于海水中的CO2主要以四种无机碳形式存在,除CO2、H2CO3两种分子外,还有两种离子的化学式为_________、___________________。
②在海洋碳循环中,可通过上图所示的途径固碳。写出钙化作用的离子方程式:____________。
(2)将CO2与金属钠组合设计成Na-CO2电池,很容易实现可逆的充、放电反应,该电池反应为4Na+3CO2 ![]() 2Na2CO3+C。放电时,在正极得电子的物质为___________;充电时,阳极的反应式为___________。
2Na2CO3+C。放电时,在正极得电子的物质为___________;充电时,阳极的反应式为___________。
(3)目前工业上有一种方法是用CO2和H2在230℃并有催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5molCO2和1.5 mol H2转化率达80%时的能量变化示意图。能判断该反应达到化学平衡状态的依据_______(填字母)。
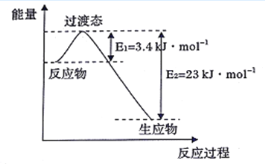
a.容器中压强不变 b.H2的体积分数不变
c.c(H2 =3c(CH3OH) d.容器中密度不变
e.2个C = O断裂的同时有6个H - H断裂
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g) +H2(g),得到如下三组数据:
CO2(g) +H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验2条件下平衡常数K=____________。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值_________(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v(正____v(逆)(填“ <”、“ >”或“=")。
(5)已知在常温常压下:
①2CH3OH(I)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJmol-1
②2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ·mol-1
③H2O(g)=H2O(I) △H=-44.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式_____________。
【题目】向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2) ![]() 0.015mol时发生的反应是:
0.015mol时发生的反应是:
2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3。下列对应关系正确的是
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
A. A B. B C. C D. D