��Ŀ����
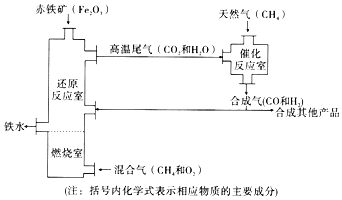
����Ŀ��CO2��ת���������������о�����Ҫ��Ӧ�á�
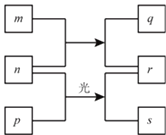
(1)CO2�ĵ�̼ת�ͶԵ�������仯������Ҫ���壬�����ǵ�����̼Ԫ�����ġ����ճء���
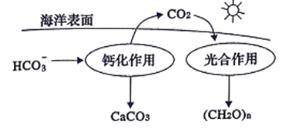
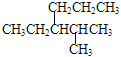
�����ں�ˮ�е�CO2��Ҫ��������̼��ʽ���ڣ���CO2��H2CO3���ַ����⣬�����������ӵĻ�ѧʽΪ_________��___________________��
���ں���̼ѭ���У���ͨ����ͼ��ʾ��;����̼��д���ƻ����õ����ӷ���ʽ��____________��
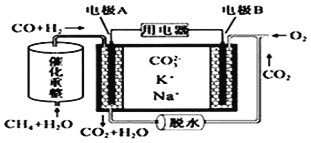
(2)��CO2������������Ƴ�Na��CO2��أ�������ʵ�ֿ���ij䡢�ŵ練Ӧ���õ�ط�ӦΪ4Na+3CO2 ![]() 2Na2CO3+C���ŵ�ʱ���������õ��ӵ�����Ϊ___________�����ʱ�������ķ�ӦʽΪ___________��
2Na2CO3+C���ŵ�ʱ���������õ��ӵ�����Ϊ___________�����ʱ�������ķ�ӦʽΪ___________��
(3)Ŀǰ��ҵ����һ�ַ�������CO2��H2��230�沢�д���������ת�����ɼ״�������ˮ��������ͼ��ʾ��ѹ������0.5molCO2��1.5 mol H2ת���ʴ�80%ʱ�������仯ʾ��ͼ�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬������_______(����ĸ)��
a.������ѹǿ���� b.H2�������������
c.c(H2 =3c(CH3OH) d.�������ܶȲ���
e.2��C = O���ѵ�ͬʱ��6��H - H����
(4)����ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO(g)+H2O(g)![]() CO2(g) +H2(g)���õ������������ݣ�
CO2(g) +H2(g)���õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ���� ��ʱ��/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
��ʵ��2������ƽ�ⳣ��K=____________��
��ʵ��3�У���ƽ��ʱ��CO��ת���ʴ���ˮ��������a/b��ֵ_________(�����ֵ��ȡֵ��Χ����
��ʵ��4����900��ʱ���ڴ������м���CO��H2O��CO2��H2��Ϊ1mol�����ʱv(��____v(�棩��� <������ >����=")��
(5)��֪�ڳ��³�ѹ�£�
��2CH3OH(I)+3O2(g)=2CO2(g)+4H2O(g) ��H=-1275.6kJmol-1
��2CO(g)+O2(g)=2CO2(g) ��H=-566.0kJ��mol-1
��H2O(g)=H2O(I) ��H=-44.0kJ��mol-1
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ_____________��
���𰸡� HCO3- CO32- Ca2 ++2HCO3 = CaCO3��+CO2��+H2O CO2 C-4e +2CO32- =3CO2 bd 1/6 �� 0.17 <1 < CH3OH(l) +O2(g)�TCO(g) +2H2O(1) ��H= -442.8 kJ mol -1
����������1����H2CO3�Ƕ�Ԫ���ᣬ�������HCO3-��CO32-�����ں���̼ѭ���У�ͨ����ͼ��ʾ��;����̼����Ӧ����HCO3-����������CaCO3��CO2����ƻ����õ����ӷ���ʽ��Ca2 ++2HCO3 = CaCO3��+CO2��+H2O��(2)���ݵ�ط�Ӧ4Na+3CO2 ![]() 2Na2CO3+C��֪���ŵ�ʱ��������ʧȥ���ӣ�����CO2ʧȥ���ӣ����ʱ������̼ʧȥ������̼������ӽ�ϲ���������̼�����ķ�ӦʽΪ��C-4e +2CO32- =3CO2����3��a���÷�Ӧ���ں�ѹ�����н��У�����ѹǿʼ�ղ��䣬�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��ѡ��a����b����ƽ��ʱ�������ʵĺ��������ٸı䣬��������������㶨�������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��ѡ��b��ȷ��c��ƽ��ʱ�������ͼ״���Ũ�Ȳ�һ���߱���ѧ�������ı�����ϵ�������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��ѡ��c����d�����ڸ÷�Ӧ�Ƿ�Ӧǰ����������ʵ����ı�ķ�Ӧ����ѹǿ����ʱ����������ڼ�С���ܶ�����ƽ��ʱ�����ܶȲ��������ֲ��䣬���жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��ѡ��d��ȷ��e����Ӧ���κ�״̬ʱ����2��C��O���ѵ�ͬʱ��6��H��H���ѣ������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��ѡ��e����ѡbd��
2Na2CO3+C��֪���ŵ�ʱ��������ʧȥ���ӣ�����CO2ʧȥ���ӣ����ʱ������̼ʧȥ������̼������ӽ�ϲ���������̼�����ķ�ӦʽΪ��C-4e +2CO32- =3CO2����3��a���÷�Ӧ���ں�ѹ�����н��У�����ѹǿʼ�ղ��䣬�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��ѡ��a����b����ƽ��ʱ�������ʵĺ��������ٸı䣬��������������㶨�������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��ѡ��b��ȷ��c��ƽ��ʱ�������ͼ״���Ũ�Ȳ�һ���߱���ѧ�������ı�����ϵ�������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��ѡ��c����d�����ڸ÷�Ӧ�Ƿ�Ӧǰ����������ʵ����ı�ķ�Ӧ����ѹǿ����ʱ����������ڼ�С���ܶ�����ƽ��ʱ�����ܶȲ��������ֲ��䣬���жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��ѡ��d��ȷ��e����Ӧ���κ�״̬ʱ����2��C��O���ѵ�ͬʱ��6��H��H���ѣ������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��ѡ��e����ѡbd��
(4) ��ʵ��2������ CO(g) + H2O(g) ![]() CO2(g) + H2(g)
CO2(g) + H2(g)
��ʼʱ��Ũ��/mol/L 1.0 0.5 0 0
�ı��Ũ��/mol/L 0.2 0.2 0.2 0.2
ƽ��ʱ��Ũ��/mol/L 0.8 0.3 0.2 0.2
K=![]() =
=![]() =
=![]() ����ʵ��3��CO��H2O����ʼŨ�ȷֱ�Ϊ
����ʵ��3��CO��H2O����ʼŨ�ȷֱ�Ϊ![]() mol/L��
mol/L��![]() mol/L����CO�ı仯Ũ��Ϊxmol/L������CO��H2O�ı仯Ũ��֮�ȵ��ڻ�ѧ����ʽ��ϵ��֮�ȣ���H2O�ı仯Ũ��Ϊxmol/L����CO��H2O��ƽ��ת���ʷֱ�Ϊ
mol/L����CO�ı仯Ũ��Ϊxmol/L������CO��H2O�ı仯Ũ��֮�ȵ��ڻ�ѧ����ʽ��ϵ��֮�ȣ���H2O�ı仯Ũ��Ϊxmol/L����CO��H2O��ƽ��ת���ʷֱ�Ϊ![]() ��
��![]() ����CO��ƽ��ת���ʴ���ˮ��������
����CO��ƽ��ת���ʴ���ˮ��������![]() >
>![]() ������
������![]() <1��
<1��
�۸���ʵ��2��֪900��ʱ��ƽ�ⳣ��K��0.17������ʵ��2�й���ֵ���ʼ���ʵ�����ƽ�����ʵ�����֪���������Ϊ2L������c=![]() ��ʵ��4ʱCO��H2O��CO2��H2��Ũ�ȷֱ�Ϊ5mol/L��2.5mol/L��1mol/L��2.5mol/L����Q=
��ʵ��4ʱCO��H2O��CO2��H2��Ũ�ȷֱ�Ϊ5mol/L��2.5mol/L��1mol/L��2.5mol/L����Q=![]() =0.2>K=0.17��˵����ʱ��ӦӦ�����淴Ӧ������У�����v(��)<v(��)��(5)����֪����2CH3OH(I) +3O2(g)=2CO2(g) +4H2O(g) ��H1= -1275.6 kJ mol-1
=0.2>K=0.17��˵����ʱ��ӦӦ�����淴Ӧ������У�����v(��)<v(��)��(5)����֪����2CH3OH(I) +3O2(g)=2CO2(g) +4H2O(g) ��H1= -1275.6 kJ mol-1
��2CO(g) +O2(g)=2CO2(g) ��H2 = -566.0 kJ��mol-1
��H2O(g)=H2O(I) ��H3 =-44.0 kJ��mol-1
���ݸ�˹���ɣ���![]() ����-��+�ۡ�4���ã�CH3OH(l) +O2(g)�TCO(g) +2H2O(1) ��H= ��H1+��H2-4��H3=
����-��+�ۡ�4���ã�CH3OH(l) +O2(g)�TCO(g) +2H2O(1) ��H= ��H1+��H2-4��H3= ![]() �� [-1275.6 kJ mol-1+(-566.0 kJ��mol-1)-( -44.0 kJ��mol-1) ��4]=-442.8 kJ mol -1��
�� [-1275.6 kJ mol-1+(-566.0 kJ��mol-1)-( -44.0 kJ��mol-1) ��4]=-442.8 kJ mol -1��

 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�