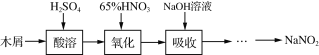
题目内容
【题目】以冶铝的废弃物铝灰为原料制取超细α氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
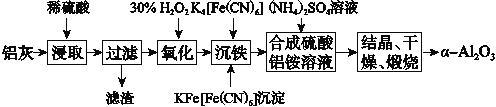
(1)铝灰中氧化铝与硫酸反应的化学方程式为__________________________。
(2)图中“滤渣”的主要成分为________(填化学式)。
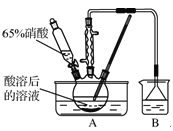
(3)加30% H2O2溶液发生反应的离子方程式为_________________________。
(4)煅烧硫酸铝铵晶体,发生的主要反应为
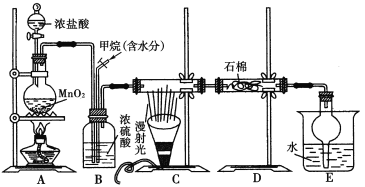
4[NH4Al(SO4)2·12H2O]2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过如图所示的装置。

①集气瓶中收集到的气体是________(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有________(填化学式)。
③KMnO4溶液褪色(MnO被还原为Mn2+),发生反应的离子方程式为______________。
【答案】(1)Al2O3+3H2SO4===Al2(SO4)3+3H2O (2分)
(2)SiO2(1分) (3)2Fe2++H2O2+2H+===2Fe3++2H2O (2分)
(4)①N2 (1分)②SO3、NH3 (2分)
③2MnO+5SO2+2H2O===2Mn2++5SO+4H+ (2分)
【解析】
试题分析:铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3)加稀硫酸,Al2O3、FeO、Fe2O3转化为离子,SiO2不溶于硫酸,过滤,滤液中含有Al3+、Fe2+、Fe3+,加双氧水,Fe2+被氧化为Fe3+,加入K4[Fe(CN)6]Fe3+转化为沉淀,过滤,在滤液中加入硫酸铵,生成NH4Al(SO4)2,结晶、干燥、煅烧得到α-Al2O3;
(1)Al2O3与硫酸反应生成硫酸铝和水,其反应的方程式为:Al2O3+3H2SO4=Al2(SO4)3+3H2O;故答案为:Al2O3+3H2SO4=Al2(SO4)3+3H2O;(2)铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3)加稀硫酸,Al2O3、FeO、Fe2O3转化为离子,SiO2不溶于硫酸,过滤,滤渣为SiO2;故答案为:SiO2;(3)滤液中含有Al3+、Fe2+、Fe3+,加30%的H2O2溶液Fe2+被氧化为Fe3+,其反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;(4)①NH4Al(SO4)212H2O分解生成的气体NH3和SO3被亚硫酸钠吸收,二氧化硫被高锰酸钾吸收,所以最后集气瓶中收集到的气体是N2;故答案为:N2;②NH3极易溶于水,NH3所以能被亚硫酸钠溶液吸收,SO3与水反应是硫酸,则SO3也被亚硫酸钠溶液吸收,所以足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有SO3、NH3;故答案为:SO3、NH3;③酸性条件下,KMnO4与二氧化硫反应生成硫酸根离子和锰离子,其反应的离子方程式为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+。

 阅读快车系列答案
阅读快车系列答案