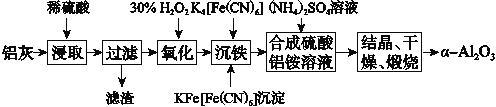
题目内容
【题目】I、通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答。
(1)用化学符号表示下列微粒:C:________,D:_________。
(2)写出A、B、E三种微粒反应的离子方程式:______________________。
II、A、B、C、D、E是原子序数依次增大的五种短周期元素,A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物的化学式为AE,其分子中含18个电子。请回答下列问题:
(1)D元素的原子结构示意图为___________________。
(2)由A、B、C三种元素形成的化合物的电子式为_________________,这种化合物中所含的化学键类型有___________________。
(3)A2B的沸点高于A2D,其原因是______________________。
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是_________________(用离子方程式表示);将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),溶液的pH近似为7,则该过程的总化学反应方程式为___________________。
【答案】Ⅰ.(1)NH4+OH-;
(2)Al3++3NH3+3H2O=Al(OH)3↓+3 NH4+或Mg2++2NH3+2H2O=Mg(OH)2↓+2NH4+;
Ⅱ.(1)![]() ;(2)
;(2)![]() ;离子键、共价键;(3)H2O分子之间存在氢键;
;离子键、共价键;(3)H2O分子之间存在氢键;
(4)ClO-+H2O![]() HClO+OH-;2NaClO =2NaCl+O2↑;
HClO+OH-;2NaClO =2NaCl+O2↑;
【解析】试题分析:Ⅰ、(1)10电子微粒有:H2O、NH3、CH4、HF、NH4+、OH-、Al3+、Na+、O2-、F-等微粒,A、B、E三种微粒反应后可得C和一种白色沉淀,该白色沉淀为Al(OH)3或Mg(OH)2,应为Al3+或Mg2+和氨水溶液的反应,则C为NH4+,B溶于A,说明A为H2O,B为NH3,D应为OH-,故答案为:NH4+;OH-;
(2)氨水溶液呈碱性,Al3+或Mg2+和氨水溶液的反应生成Al(OH)3或Mg(OH)2,反应的离子方程式为Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+,故答案为:Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+;
Ⅱ.A、B、C、D、E是原子序数依次增大的五种短周期元素,A原子的电子层数与它的核外电子总数相同,则A为氢元素;A与E形成的化合物化学式为AE,其分子中含18个电子,故E为氯元素;A与C同主族,处于ⅠA族,B和C的最外层电子数之和与E的最外层电子数相同,则B的最外层电子数为7-1=6,处于ⅥA族,B与D为同主族,原子序数B小于D,则B为氧元素,D为硫元素;C原子序数大于氧元素,C与氢元素为同主族,故C为钠元素。
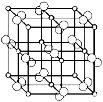
(1)D为硫元素,原子结构示意图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)由A、B、C三种元素形成的化合物为NaOH,氢氧化钠是离子化合物,由钠离子与氢氧根离子构成,电子式为![]() .晶体中钠离子与氢氧根离子之间形成离子键,氢氧根离子中氢原子与氧原子之间形成共价键,故答案为:
.晶体中钠离子与氢氧根离子之间形成离子键,氢氧根离子中氢原子与氧原子之间形成共价键,故答案为:![]() ;离子键、共价键;
;离子键、共价键;
(3)H2O分子间存在氢键而H2S分子间不存在氢键,故H2O的沸点比H2S高,故答案为:H2O分子之间存在氢键;
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,该盐为NaClO,次氯酸钠属于强碱弱酸盐,在溶液中ClO-发生水解:ClO-+H2O![]() HClO+OH-,使溶液呈碱性,溶液pH>7;将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),HClO分解为HCl与氧气,HCl与氢氧化钠反应生成NaCl,故最终溶液几乎为NaCl溶液,溶液的pH近似为7,则该过程的总反应方程式为2NaClO=2NaCl+O2↑,故答案为:ClO-+H2O
HClO+OH-,使溶液呈碱性,溶液pH>7;将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),HClO分解为HCl与氧气,HCl与氢氧化钠反应生成NaCl,故最终溶液几乎为NaCl溶液,溶液的pH近似为7,则该过程的总反应方程式为2NaClO=2NaCl+O2↑,故答案为:ClO-+H2O![]() HClO+OH-;2NaClO=2NaCl+O2↑。
HClO+OH-;2NaClO=2NaCl+O2↑。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】(1)用正确的序号填空: ①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3 ;
互为同位素的是 ; 互为同素异形体的是 ;
互为同分异构体的是 ; 互为同系物的是
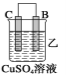
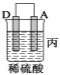
(2)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不 断溶解 | C的质 量增加 | A上有气 体产生 |
根据实验现象回答下列问题:
①装置甲中作正极的是_____ ___ (填“A”或“B”)。
②装置乙溶液中Cu2+向_____ __极移动(填“B”或“C”)。
③装置丙中金属A上电极反应属于___ ___(填“氧化反应”或“还原反应”)。
④四种金属活动性由强到弱的顺序是____ ___。
【题目】
物 质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
乙 醇 | -117.0 | 78.0 | 0.79 |
乙 酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) | —— | 338.0 | 1.84 |
某学生在实验室制取乙酸乙酯的主要步骤如下:
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液。
②按如图1所示连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10分钟
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置,等待分层.
④分离出乙酸乙酯层并洗涤、干燥。
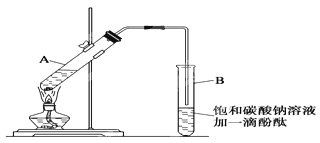
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为:______,写出制取乙酸乙酯的化学方程式:______.
(2)上述实验中饱和碳酸钠溶液的作用是:______(填字母)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于其分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是:______。
(4)指出步骤③所观察到的现象:______;分离出乙酸乙酯层后,一般用饱和食盐水和饱和氯化钙溶液洗涤,可通过洗涤除去______(填名称)杂质;为了干燥乙酸乙酯,可选用的干燥剂为______(填字母)。
A.P2O5B.无水Na2SO4C.碱石灰 D.NaOH固体
(5)某化学课外小组设计了如下图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与上图的装置相比,下图装置的主要优点有:____________、_________。(写出两条即可)