题目内容
一定温度下,某容积恒定的密闭容器中发生如下可逆反应:CO(g)+H2(g)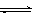 C(s)+H2O(g);△H<0以l mol CO和2 mol H2为起始反应物,tl时达到平衡,生成0.6mol H2O(g)。t2时改变反应条件,化学反应速率(v)与时间(t)的关系如图所示。下列叙述正确的是
C(s)+H2O(g);△H<0以l mol CO和2 mol H2为起始反应物,tl时达到平衡,生成0.6mol H2O(g)。t2时改变反应条件,化学反应速率(v)与时间(t)的关系如图所示。下列叙述正确的是
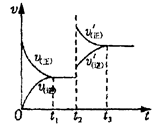
 C(s)+H2O(g);△H<0以l mol CO和2 mol H2为起始反应物,tl时达到平衡,生成0.6mol H2O(g)。t2时改变反应条件,化学反应速率(v)与时间(t)的关系如图所示。下列叙述正确的是
C(s)+H2O(g);△H<0以l mol CO和2 mol H2为起始反应物,tl时达到平衡,生成0.6mol H2O(g)。t2时改变反应条件,化学反应速率(v)与时间(t)的关系如图所示。下列叙述正确的是
| A.起始时刻和t1达到平衡后气体的物质的量之比为4︰5 |
| B.平衡后若加入少量碳,平衡向逆反应方向移动 |
| C.平衡后若加入氢气,上述反应的△H会增大 |
| D.t2时改变的条件可能是增大了压强 |
D
试题分析:tl时达到平衡,生成0.6mol H2O(g),则根据方程式可知,消耗CO和氢气的物质的量元素0.6mol,则剩余CO和氢气的物质的量分别是0.4mol和1.4mol,所以起始时刻和t1达到平衡后气体的物质的量之比为3︰2.4=5︰4,A不正确;碳是固体,改变固体的质量,平衡不移动,B不正确;反应热对于具体的化学方程式是不变的,C不正确;增大压强,正逆反应速率都增大,平衡向正反应方向移动,D正确,答案选D。
点评:在判断外界条件对平衡状态的影响时,需要特别注意的是浓度和压强。前者不能适用于固体或纯液体,后者只能适用于气体体系。

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
 3C(g)达到平衡的标志是:
3C(g)达到平衡的标志是: 3C(g)+2D(g),起始时四个容器所盛A、B的量分别为:甲:2 mol A,1 mol B;乙:1 mol A,1 mol B;丙:2 mol A,2 mol B;丁:1 mol A,2 mol B。在相同温度下建立平衡时,A、B的转化率大小关系正确的是( )
3C(g)+2D(g),起始时四个容器所盛A、B的量分别为:甲:2 mol A,1 mol B;乙:1 mol A,1 mol B;丙:2 mol A,2 mol B;丁:1 mol A,2 mol B。在相同温度下建立平衡时,A、B的转化率大小关系正确的是( ) 2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是
2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是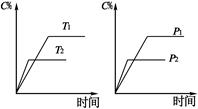
 2G(g)若开始时只充入2molG(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入2molM和1molN的混合气体,达平衡时M的转化率为
2G(g)若开始时只充入2molG(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入2molM和1molN的混合气体,达平衡时M的转化率为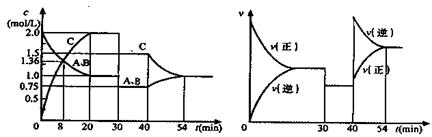
 NaCl(l)+ K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
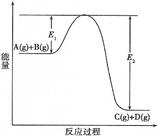
NaCl(l)+ K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。