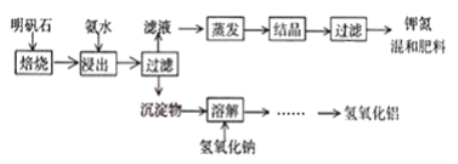
题目内容
【题目】FeCl2是一种用途广泛的化工产品。由于在水溶液中难以得到高纯度的FeCl2,某课题小组设计氯化铁和氯苯反应制得高纯度的FeCl2。
(查阅资料)①在加热条件下,氯化铁遇水剧烈水解。
②2FeCl3 +C6H5Cl →C6H4Cl2 + 2FeCl2 + HCl↑
③有关数据如下:
C6H5Cl(氯苯) | C6H4Cl2(对二氯苯) | FeCl3 | FeCl2 | |
式量 | 112.5 | 147 | 162.5 | 127 |
溶解性 | 不溶于水,易溶于苯 | 溶于水,不溶于C6H5Cl、C6H4Cl2、苯 | ||
熔点/℃ | -45 | 53 | —— | —— |
沸点/℃ | 132 | 173 | —— | —— |
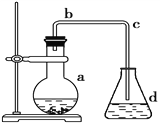
(实验过程)按下图装置,在三颈烧瓶中放入a g无水氯化铁和过量的氯苯,控制反应温度在128~139℃加热3h,冷却,分离提纯A中物质得到产品。
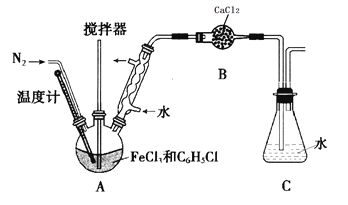
回答下列问题:
(1)实验装置中,仪器B的名称是________________。
(2)反应前后都需要通入N2的目的是_____________。
(3)实验过程中控制反应温度128~139℃,C6H5Cl不会有明显损失,原因是_____________。
(4)充分反应后,冷却。对三颈烧瓶内的物质进行过滤,用苯洗涤沉淀,干燥得到产品。回收滤液中C6H5Cl的方案为_______________。
(5)经检验产品中不含有FeCl3。取少量所得产品溶解于盐酸中,配制成溶液。向盛有H2O2溶液的试管中加入几滴配制的溶液,溶液变成棕黄色,一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是__________;生成沉淀的原因是(用平衡移动原理解释)__________。
【答案】干燥管 反应前,赶尽装置中的空气;反应后,将滞留在装置中的HCl赶入C中吸收 实验中采用了冷凝回流装置 蒸馏滤液,收集132℃的馏分 H2O2将Fe2+氧化成Fe3+,Fe3+对H2O2的分解具有催化作 H2O2分解反应放热,促进Fe3+的水解平衡正向移动
【解析】
(1)仪器B的名称为干燥管;
(2)反应前,赶尽装置中的空气;反应后,将滞留在装置中的HCl赶入C中吸收,因此反应前后都需要通入N2;
(3)实验过程中需控制反应温度为128~139℃,C6H5Cl没有明显损失,是由于在本实验中使用了球形冷凝管,起到了冷凝回流的作用;
(4)若回收滤液中C6H5Cl,由于C6H5Cl的沸点为132℃,因此可蒸馏滤液,收集132℃的馏分;
(5)产生气泡的原因是H2O2将Fe2+氧化成Fe3+,Fe3+对H2O2的分解具有催化作用;生成沉淀的原因是H2O2分解反应放热,促进Fe3+的水解平衡正向移动。

 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案