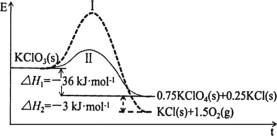
题目内容
【题目】25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为__(用化学式表示);
(2)体积为10 mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1 000 mL,稀释后溶液的pH,前者__后者(填“>”、“<”或“=”);
(3)25℃时,pH之和为14的CH3COOH溶液与NaOH溶液混合,充分反应后溶液显中性,则所耗溶液的体积前者__后者(填“>”、“<”或“=”);
(4)若用NaOH标准溶液滴定未知浓度的醋酸,选择的指示剂应为_;
(5)下列离子CH3COO-、CO32-、HCO3-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为___;
(6)25℃时,把100mLpH为2的盐酸变为3,若分别用加入蒸馏水和加入pH为4的稀硫酸,则所需蒸馏水和pH为4的稀硫酸的体积之比为__。
【答案】H2SO3>CH3COOH>H2CO3 < < 酚酞 CO32->SO32->HCO3->CH3COO->HSO3- 9:10
【解析】
根据此规律进行解答:
(1)电离平衡常数越大,酸的电离程度越大,溶液酸性越强,则电解质越强;
(2)设出该醋酸的电离度,然后根据该稳定性醋酸的电离平衡常数列式计算;酸性越弱,稀释后溶液的pH变化越大;
(3)酸根离子对应酸的酸性越强,该酸根离子结合氢离子能力越弱。
(1)电离平衡常数越大说明电离能力越强,由电离平衡的数据可得出电解质强弱顺序为:H2SO3>CH3COOH>H2CO3。
故答案为:H2SO3>CH3COOH>H2CO3
(2)pH相同的醋酸和亚硫酸,醋酸的浓度远大于亚硫酸的浓度,稀释相同的倍数,亚硫酸的pH变化大,则稀释后的醋酸电离出的氢离子浓度大于亚硫酸电离出的氢离子浓度,醋酸溶液的pH<亚硫酸溶液的pH。
故答案为:<。
(3)pH之和为14的CH3COOH溶液与NaOH溶液等体积混合后,所得溶液是醋酸和醋酸钠的混合物,若溶液显中性PH=7时,则CH3COOH溶液体积应小于NaOH溶液体积。
故答案为<。
(4)用NaOH溶液滴定醋酸溶液是强碱滴定弱酸的中和滴定,在等当量点(等当点)时,溶液略带碱性(因为此时醋酸已被完全中和,但生成的醋酸钠要被水解而产生醋酸和氢氧化钠,醋酸微弱电离而氢氧化钠强烈离解使液略显碱性),因此要用变色范围在 pH 8.0-10.0 之间的酚酞指示剂。
故答案为酚酞。
(5)已知酸性:H2SO3>CH3COOH>H2CO3>HSO3->HCO3-,酸根离子对应酸的酸性越强,该酸根离子结合氢离子能力越弱,则CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为:CO32->SO32->CH3COO->HSO3-,
故答案为:CO32->SO32->CH3COO->HSO3-
(6)盐酸的PH由2变为3,则酸中c(H+)由0.01mol/L变为0.001mol/L。溶液稀释前后溶质的物质的量不变,则稀释后的溶液体积为V=![]() mL=1000 mL,故加水的体积为900 mL。设要加入的pH为4的稀硫酸的体积为V L,则混合液中c(H+)=
mL=1000 mL,故加水的体积为900 mL。设要加入的pH为4的稀硫酸的体积为V L,则混合液中c(H+)=![]() =0.001mol/L,计算得V=1L=1000 mL。则所需蒸馏水和pH为4的稀硫酸的体积之比为900:1000=9:10。
=0.001mol/L,计算得V=1L=1000 mL。则所需蒸馏水和pH为4的稀硫酸的体积之比为900:1000=9:10。
故答案为9:10。