题目内容
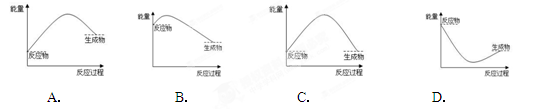
可逆反应A+B(s) C达到平衡后,无论加压或降温,B的转化率都增大,则下列结论正确的是( )
C达到平衡后,无论加压或降温,B的转化率都增大,则下列结论正确的是( )
A. A为固体,C为气体,正反应为放热反应
B. A为气体,C为固体,正反应为放热反应
C. A为气体,C为固体,正反应为吸热反应
D. A、C均为气体,正反应为吸热反应
B
解析试题分析:达到平衡后,无论加压或降温,B的转化率都增大,即无论加压或降温,平衡都向正反应方向移动,则根据勒夏特例原理可知,正反应是放热反应,同时气体的体积是减小的。由于反应物B是固体,则根据反应的化学计量数可知,A是气体,C是固体或纯液体,答案选B。
考点:考查外界条件对平衡状态的影响
点评:该题是中等难度的试题,也是高考中的常见题型和重要的考点。主要是考查学生对平衡状态的含义以及外界条件是如何影响平衡状态的了解掌握情况,旨在培养学生分析、归纳和总结问题的能力。该题的关键是灵活运用勒夏特例原理。

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
下列说法或表示方法正确的是 ( )
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ·mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ |
C.300℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·mol-1 2NH3(g) △H=-38.6kJ·mol-1 |
| D.由C(石墨)=C(金刚石)△H=" +1.90" kJ·mol-1可知,金刚石比石墨稳定 |
已知298 K,101 kPa时,2SO2(g)+O2(g)  2SO3(g);ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是( )
2SO3(g);ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是( )
| A.Q2<Q1<197 kJ·mol-1 | B.Q2=Q1=197 kJ·mol-1 |
| C.Q1<Q2<197 kJ·mol-1 | D.Q2=Q1<197 kJ·mol-1 |

 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 

 O2(g)=
O2(g)= P4O10(s);Δ H=-738.5KJ·mol-1
P4O10(s);Δ H=-738.5KJ·mol-1 说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的 总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。
说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的 总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。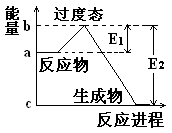
 CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________.
CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________.  2SO3(g)
2SO3(g) 2SO3(g) △H= 。
2SO3(g) △H= 。