题目内容
【题目】一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下。请回答下列问题:
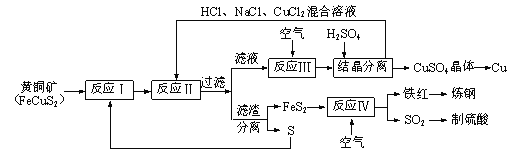
(1)反应Ⅲ的离子方程式为4CuCl2-+O2+4H+=4Cu2++8Cl-+2H2O,CuCl2-中铜元素的化合价为______,该反应中的氧化剂是___________。
(2)一定温度下,在反应Ⅲ所得的溶液中加入硫酸,可以析出硫酸铜晶体而不析出氯化铜晶体,其原因可能是____________________________________________________。
(3)炼钢时,可将铁红投入熔融的生铁中,以降低生铁的含碳量,该过程中主要反应的化学方程式是______________________________________________________________。
(4)SO2尾气直接排放到大气中造成环境污染的后果是_____________________________。
(5)已知反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2CuCl2-+S,反应Ⅰ的产物为_____________和_____________。(填化学式)
【答案】(1)+1(1分) O2 (1分) (2)该温度下,硫酸铜的溶解度小于氯化铜(2分)
(3)3C+Fe2O3![]() 2Fe+3CO↑(2分)(4)形成酸雨(1分)(5)FeS2、CuS(2分)
2Fe+3CO↑(2分)(4)形成酸雨(1分)(5)FeS2、CuS(2分)
【解析】
试题分析:(1)CuCl2-中氯元素的化合价是-1价,则根据正负价代数和为0可知铜元素的化合价为+1价;反应Ⅲ的离子方程式为4CuCl2-+O2+4H+=4Cu2++8Cl-+2H2O,在反应中铜元素化合价从+1价升高到+2价失去电子,氧气中氧元素化合价从0价降低到-2价,得到电子,所以该反应中的氧化剂是氧气。
(2)一定温度下,在反应Ⅲ所得的溶液中加入硫酸,可以析出硫酸铜晶体而不析出氯化铜晶体,这说明该温度下,硫酸铜的溶解度小于氯化铜。
(3)炼钢时,可将铁红投入熔融的生铁中,以降低生铁的含碳量,这说明 高温下氧化铁能与碳反应,因此该过程中主要反应的化学方程式是3C+Fe2O3![]() 2Fe+3CO↑。
2Fe+3CO↑。
(4)SO2尾气直接排放到大气中造成环境污染的后果是形成酸雨。
(5)已知反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2CuCl2-+S,这说明反应Ⅰ的产物一定有CuS。而反应Ⅱ过滤后的生成物有FeS2,因此反应Ⅰ的产物还有FeS2。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。(已知:S2O32-+2H+=H2O+S↓+SO2↑)

(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是_______________;除如图装置所示的实验用品、仪器外,还需要的意见实验仪器是__________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是________________________。
(3)试简述测定该反应的化学反应速率的其他方法:__________________(写一种)。
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表。(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
实验 序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(4)该实验进行的目的是_____________淀粉溶液的作用是____________。
(5)表中Vx=_______mL,比较t1、t2、t3大小,试推测该实验结论: ____________
【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)表中最活泼的金属是__________,单质能用作半导体材料的是__________,化学性质最稳定的是__________ (填写元素符号)。
(2)表中能形成两性氢氧化物的元素是_________ (填写元素符号),分别写出该元素的氢氧化物与⑥和⑨最高价氧化物的水化物反应的化学方程式:_________________________。
(3)③与⑩组成的化合物属于__________(填“离子化合物”或“共价化合物”)用电子式表示该化合物的形成过程________________________________。①的氢化物中含有__________(填“离子键”或“极性共价键”或“非极性共价键”)的电子式是__________。
(4)⑦和⑩的氢化物中沸点较高的是__________(写化学式)原因是_________。
(5)请设计一个实验,比较⑦⑩单质氧化性的强弱:________________________________。