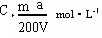题目内容
将溶质的质量分数为a%、物质的量浓度为C1 mol?L-1的H2SO4溶液蒸发掉一定量的水,使其溶质的质量分数变为2a%,此时物质的量浓度为C2 mol?L-1,则C1和C2的关系是
- A.C2>2C1
- B.C2=2C1
- C.C2<2C1
- D.C1=2C2
A
分析:利用c=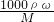 计算硫酸的物质的量浓度,再根据硫酸溶液的浓度越大密度也越大,进行判断.
计算硫酸的物质的量浓度,再根据硫酸溶液的浓度越大密度也越大,进行判断.
解答:设将溶质质量分数为a%的硫酸溶液密度为ρ1,
则c1= mol/L=
mol/L=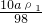 mol/L,
mol/L,
设将溶质质量分数为2a%的硫酸溶液密度为ρ2,
则c2= mol/L=
mol/L= mol/L,
mol/L,
所以c1:c2=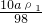 mol/L:
mol/L: mol/L=ρ1:2ρ2,
mol/L=ρ1:2ρ2,
即c2= c1
c1
硫酸溶液的浓度越大密度也越大,所以ρ2>ρ1,所以 >2
>2
所以c2>2c1.
故选A.
点评:本题考查物质的量浓度与质量分数的相互换算,可利用定义计算,难度中等,关键清楚硫酸溶液的浓度越大密度也越大,注意氨水、酒精浓度越大密度越小.
分析:利用c=
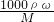 计算硫酸的物质的量浓度,再根据硫酸溶液的浓度越大密度也越大,进行判断.
计算硫酸的物质的量浓度,再根据硫酸溶液的浓度越大密度也越大,进行判断.解答:设将溶质质量分数为a%的硫酸溶液密度为ρ1,
则c1=
 mol/L=
mol/L=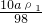 mol/L,
mol/L,设将溶质质量分数为2a%的硫酸溶液密度为ρ2,
则c2=
 mol/L=
mol/L= mol/L,
mol/L,所以c1:c2=
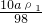 mol/L:
mol/L: mol/L=ρ1:2ρ2,
mol/L=ρ1:2ρ2,即c2=
 c1
c1硫酸溶液的浓度越大密度也越大,所以ρ2>ρ1,所以
 >2
>2所以c2>2c1.
故选A.
点评:本题考查物质的量浓度与质量分数的相互换算,可利用定义计算,难度中等,关键清楚硫酸溶液的浓度越大密度也越大,注意氨水、酒精浓度越大密度越小.

练习册系列答案
相关题目