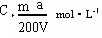题目内容
将溶质的质量分数为a%、物质的量浓度为C1mol?L-1的稀硫酸加热蒸发掉一定量水,使溶质的质量分数变为2a%,此时硫酸的物质的量浓度为C2mol?L-1,C1和 C2的关系是( )
分析:溶质的质量分数变为2a%,则溶液的质量减小一半,硫酸溶液的浓度越大,密度越大,则蒸发后溶液的体积小于原来的一半,根据溶液蒸发前后溶质的物质的量不变计算.
解答:解:质量分数由a→2a%,即蒸发的水的质量为原溶液的一半,设原溶液1 L,
则n(H2SO4)=1 L×c1 mol?L-1=c1 mol,
设溶液的质量为1000ρ1,蒸发掉水后,溶液质量为
,
故溶液的体积为
/ρ2 mL=
L,
所以c2=
=
=2c1?
,
而ρ2>ρ1,
则c2>2c1.
故选C.
则n(H2SO4)=1 L×c1 mol?L-1=c1 mol,
设溶液的质量为1000ρ1,蒸发掉水后,溶液质量为
| 1000ρ1 |
| 2 |
故溶液的体积为
| ||
| ρ2 |
| ρ1 |
| 2ρ2 |
所以c2=
| n |
| V |
| 1L×c1 | ||
|
| ρ2 |
| ρ1 |
而ρ2>ρ1,
则c2>2c1.
故选C.
点评:本题考查物质的量浓度的计算,题目难度不大,注意蒸发前后溶质的物质的量不变,以及溶液密度的变化,

练习册系列答案
相关题目