题目内容
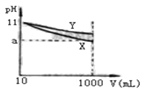
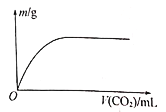
【题目】W、X、Y、Z为原子序数依次增大的四种短周期元素,其中两种为非金属元素。W的气态氢化物遇到其最高价氧化物对应的水化物产生“白烟”,Z的最外层电子数等于其电子层数的2倍,W和X的最外层电子数之和等于Z的族序数。在含X和Y的可溶性盐溶液中通入过量的CO2,产生沉淀的质量与CO2体积的关系如图所示。下列说法正确的是
A. 简单离子半径:X>Y>Z>W
B. Z的氧化物对应的水化物均为强酸
C. 含Y的阴离子溶液与含Y的阳离子溶液能够发生反应
D. 工业上可用电解法或热还原法制备X和Y的单质
【答案】C
【解析】
NH3遇HNO3会生成白色固体,产生“白烟",W为氮元素;短周期元素中,原子的最外层电子数等于电子层数2倍的元素有C、S元素,Z的原子序数大于7,所以Z为硫元素;又因为W和X的最外层电子数之和等于Z的最外层电子数,所以X为钠元素;由图知,通入CO2产生沉淀。且沉淀不溶于过量的CO2,NaAlO2、Na2SiO3溶液中通入CO2产生沉淀,且硅酸、氢氧化铝不溶于CO2,但四种元素中有两种非金属元素,故Y为铝元素,不是硅元素,据此分析。
NH3遇HNO3会生成白色固体,产生“白烟",W为氮元素;短周期元素中,原子的最外层电子数等于电子层数2倍的元素有C、S元素,Z的原子序数大于7,所以Z为硫元素;又因为W和X的最外层电子数之和等于Z的最外层电子数,所以X为钠元素;由图知,通入CO2产生沉淀。且沉淀不溶于过量的CO2,NaAlO2、Na2SiO3溶液中通入CO2产生沉淀,且硅酸、氢氧化铝不溶于CO2,但四种元素中有两种非金属元素,故Y为铝元素,不是硅元素。
A、S2-、N3-、Na+、Al3+的离子半径依次减小,选项A错误;
B、硫的含氧酸有H2SO3、H2SO4,H2SO3是弱酸,选项B错误;
C、含Al3+和AlO2-的溶液能够发生反应生成氢氧化铝沉淀,选项C正确;
D、工业上可以采用电解法制备钠、铝,但是不能用热还原法制备。选项D错误。
答案选C。

 天天向上口算本系列答案
天天向上口算本系列答案