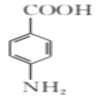
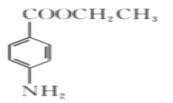
题目内容
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1mol·L-1CH3COONa溶液与0.1mol·L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.0.1mol·L-1NH4Cl溶液与0.1mol·L-1氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C.0.1mol·L-1Na2CO3溶液与0.1mol·L-1NaHCO3溶液等体积混合:![]() c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.0.1mol·L-1Na2C2O4溶液与0.1mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
【答案】A
【解析】
A、0.1 mol·L-1 CH3COONa溶液与0.1 mol·L-1 HCl溶液等体积混合,溶质为等物质的量的CH3COOH和NaCl,醋酸为弱酸,部分电离,所以c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-),A选项正确;
B、0.1 mol·L-1 NH4Cl溶液与0.1 mol·L-1氨水等体积混合,pH>7,说明一水合氨的电离程度大于铵根离子的水解程度,若不考虑NH4+水解和NH3·H2O的电离,则c(NH4+)= c(NH3·H2O)=c(Cl-),在考虑溶液中水解平衡和电离平衡后,因一水合氨的电离程度大于铵根离子的水解程度,则c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-),B选项错误;
C、根据物料守恒,0.1 mol·L-1Na2CO3溶液中,c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),0.1 mol·L-1 NaHCO3溶液中,c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),二者等体积混合,则2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),即![]() c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),C选项错误;
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),C选项错误;
D、0.1 mol·L-1 Na2C2O4溶液与0.1 mol·L-1 HCl溶液等体积混合,溶质为等物质的量的NaHC2O4和NaCl,根据电荷守恒:c(Na+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-),D选项错误。
答案为A。

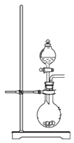
【题目】某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_____________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_______;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是_____________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究_____________________对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是_____________。