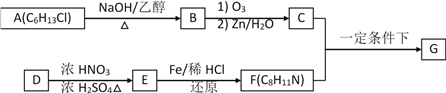题目内容
【题目】根据下列转化关系(反应条件略去),A、B、C、D中均含有同一种元素,回答下头问题:

(1)若A为Na,则固体C的颜色为__________________,写出反应③的化学方程式___________________________。
(2)若A为N2,写出反应③的化学方程式___________________________。
(3)若A为S,写出D的浓溶液与Cu在加热情况下反应的化学方程式____________________。
(4)若A为NH3,则__________(填“能”与“不能”)用铁制容器储存D的浓溶液。写出过量Fe与D的稀溶液反应(还原产物只有B)的离子方程式_______________________________。
【答案】 淡黄色 2Na2O2+2H2O===4NaOH+O2↑ 3NO2+H2O===2HNO3+NO Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 能 3Fe+8H++2NO3- === 3Fe2++2NO↑+4H2O
CuSO4+SO2↑+2H2O 能 3Fe+8H++2NO3- === 3Fe2++2NO↑+4H2O
【解析】(1). 若A为Na,由转化关系图可知,B为Na2O、C为Na2O2、D为NaOH,Na2O2是淡黄色固体,Na2O2与水反应生成NaOH和O2,化学方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:淡黄色;2Na2O2+2H2O=4NaOH+O2↑;
(2). 若A为N2,由转化关系图可知,B为NO、C为NO2、D为HNO3,反应③是二氧化氮和水反应生成硝酸和一氧化氮,化学方程式为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(3). 若A为S,由转化关系图可知,B为SO2、C为SO3、D为H2SO4,浓硫酸与Cu在加热的条件下反应生成硫酸铜、二氧化硫和水,化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(4). 若A为NH3,由转化关系图可知,B为NO、C为NO2、D为HNO3,常温下铁可被浓硝酸钝化,所以可用铁制容器储存浓硝酸,过量的Fe与稀硝酸反应生成硝酸亚铁、一氧化氮和水,离子方程式为3Fe+8H++2NO3- = 3Fe2++2NO↑+4H2O,故答案为:能;3Fe+8H++2NO3- = 3Fe2++2NO↑+4H2O。

 阅读快车系列答案
阅读快车系列答案