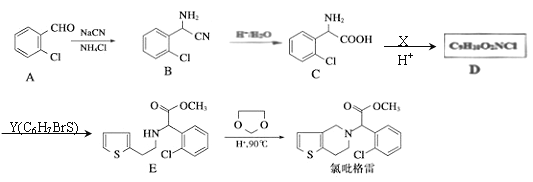
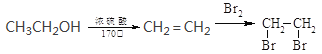题目内容
【题目】X、Y、Z、W四种常见元素,其中X\、Y、Z为短周期元素,W为过渡元素,它们的相关信息如表:
原子或分子相关信息 | 单质及其化合物相关信息 | |
X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种高温材料 |
Z | Z原子的最外层电子数是次外层电子数的 | Z广泛存在于无机非金属材料中,其单质是制取大规模集成电路的主要原料 |
W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
回答下列问题:
(1)W在周期表的位置为_________,W(OH)2在空气中不稳定,极易被氧化反应的化学方程式为_________________________________________。
(2)X的简单阴离子的结构示意图为___________________;X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为____________________________。
(3)Z的氧化物在通讯领域的用途是___________________,工业上制备Z的单质的化学反应方程式为 ___________________________________ 。
(4)YX3固体在熔融状态下不导电,则YX3固体中存在__________键;在50 mL l mol·L-1的YX3溶液中逐滴加入0.5 mol·L-1的NaOH溶液,得到1.56 g沉淀,则加入NaOH溶液的体积可能有________种情况。
【答案】 第四周期第Ⅷ族 4Fe (OH)2+O2+2H2O=4Fe (OH)3 ![]() 6H++A12O3=2A13++3H2O 制光导纤维 SiO2+2C
6H++A12O3=2A13++3H2O 制光导纤维 SiO2+2C![]() Si+2CO↑ 共价 二
Si+2CO↑ 共价 二
【解析】X、Y、Z、W四种常见元素分别为Cl、Al、Si、Fe。(1)Fe是第四周期第Ⅷ族元素;氢氧化亚铁易被氧气氧化为氢氧化铁,其反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;(2)Cl-的结构示意图为:![]() ;Cl的最高价氧化物对应水化物HClO4溶液与Y的氧化物Al2O3反应的离子方程式为:6H++A12O3=2A13++3H2O;(3)Z的氧化物SiO2最重要的用途就是生产光导纤维,工业上是用碳还原SiO2制备粗硅,再净化得到纯硅,其反应方程式为SiO2+2C
;Cl的最高价氧化物对应水化物HClO4溶液与Y的氧化物Al2O3反应的离子方程式为:6H++A12O3=2A13++3H2O;(3)Z的氧化物SiO2最重要的用途就是生产光导纤维,工业上是用碳还原SiO2制备粗硅,再净化得到纯硅,其反应方程式为SiO2+2C![]() Si+2CO↑;(4)AlCl3固体在熔融状态下不导电,则为共价化合物,固体中存在共价键;溶液中含有铝元素0.05L×1mol/L=0.05mol,生成的沉淀为
Si+2CO↑;(4)AlCl3固体在熔融状态下不导电,则为共价化合物,固体中存在共价键;溶液中含有铝元素0.05L×1mol/L=0.05mol,生成的沉淀为![]() 0.02mol,故有两种情况,一种是加入的氢氧化钠刚好生成沉淀,另一种是铝离子全生成沉淀后,再加入氢氧化钠,沉淀部分溶解。
0.02mol,故有两种情况,一种是加入的氢氧化钠刚好生成沉淀,另一种是铝离子全生成沉淀后,再加入氢氧化钠,沉淀部分溶解。

【题目】目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境。这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验。【实验Ⅰ】硫的质量确定
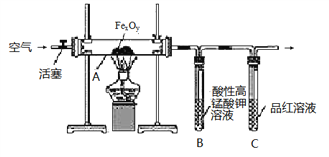
按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.00 g铁硫簇结构(含有部分不反应的杂质),在试管B中加入50.00 mL 0.1000 molL-1的酸性KMnO4溶液,在试管C中加入品红溶液。通入空气并加热,发现固体逐渐转变为红棕色。待固体完全转化后将B中溶液转移至250 mL容量瓶,洗涤试管B后定容。取25.00 mL该溶液用0.01000 molL-1的草酸(H2C2O4)进行测定剩余KMnO4溶液浓度的滴定。记录数据如下:
滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.50 | 23.70 |
2 | 25.00 | 1.02 | 26.03 |
3 | 25.00 | 0.00 | 24.99 |
相关反应:① 2MnO4- + 2H2O + 5SO2![]() 2Mn2+ + 5SO42- + 4H+
2Mn2+ + 5SO42- + 4H+
② 2MnO4- + 6H+ + 5H2C2O4![]() 2Mn2+ +10CO2↑+ 8H2O
2Mn2+ +10CO2↑+ 8H2O
【实验Ⅱ】铁的质量确定
将实验Ⅰ硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.600 g固体。
试回答下列问题:
(1)检查“实验Ⅰ”中装置气密性的方法是_______________。
(2)滴定终点的判断方法是______________。
(3)试管C中品红溶液的作用是_______________;有同学提出,撤去C装置,对实验没有影响,你的看法是___(选填“同意”或“不同意”),理由是________________。
(4)根据实验Ⅰ和实验Ⅱ中的数据可确定该铁硫簇结构的化学式为___________________。
【问题探究】
滴定过程中,细心的小明发现该KMnO4颜色褪去的速率较平常滴定时要快得多。为研究快的原因,甲同学继续进行了下列实验,实验数据如下表:
编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
1 | 25 | 5.0 | 2.0 | 40 |
2 | 25 | 5.0(另加少量可溶于水的MnSO4粉末) | 2.0 | 4 |
3 | 60 | 5.0 | 2.0 | 25 |
(5)分析上述数据,滴定过程中反应速率较快的原因可能是_____________。