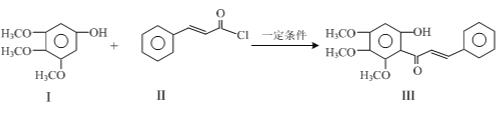
题目内容
【题目】下列物质属于共价化合物的是
A.N2B.H2OC.KOHD.CaCl2
【答案】B
【解析】
只含有共价键的化合物属于共价化合物,只含有离子键或既含有离子键又含有共价键的化合物属于离子化合物,通过分析化合物含有的化学键类型,判断化合物的种类。
A.N2的电子式为![]() ,结构简式为N≡N,分子中存在氮氮叁键,只含共价键,是单质,故A不符合题意;
,结构简式为N≡N,分子中存在氮氮叁键,只含共价键,是单质,故A不符合题意;
B.H2O的电子式为![]() ,结构中只存在氧氢共价键,为共价化合物,故B符合题意;
,结构中只存在氧氢共价键,为共价化合物,故B符合题意;
C.KOH的电子式为![]() ,结构中钾离子和氢氧根离子之间形成离子键,氢氧根中O原子和H原子之间存在共价键,KOH为离子化合物,故C不符合题意;
,结构中钾离子和氢氧根离子之间形成离子键,氢氧根中O原子和H原子之间存在共价键,KOH为离子化合物,故C不符合题意;
D.CaCl2的电子式为![]() ,结构中钙离子与氯离子之间形成离子键,为离子化合物,故D不符合题意;
,结构中钙离子与氯离子之间形成离子键,为离子化合物,故D不符合题意;
答案为B。

 阅读快车系列答案
阅读快车系列答案【题目】能源开发、环境保护、资源利用等是当今社会的热门话题。请根据所学化学知识回答下列问题:
(1)汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ·mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ·mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ·mol-1;
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)某硝酸厂利用甲醇处理废水。在一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比为______________。
(3)煤的间接液化是先转化为CO和H2,再在催化剂作用下合成甲醇。若在一定温度下,向1 L密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
物质 | CO | H2 | CH3OH |
浓度/(mol·L-1) | 1.2 | 1.0 | 0.6 |
①该反应的平衡常数表达式为:K=_____________________。
②该时间内反应速率υ(H2)=_________________。
③平衡时CO的转化率为_________________(保留1位小数)
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c