题目内容
【题目】高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。制备K2FeO4如下图:查阅资料:K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
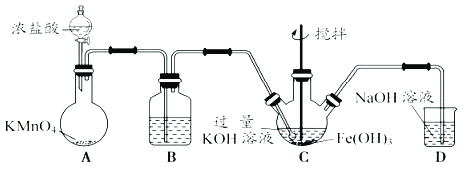
(1)A为制取氯气发生装置,其中盛放浓盐酸的仪器名称为______,A中化学反应的还原剂是______。
(2)装置B的作用是除杂,所用试剂为___________。
(3)C为制备K2FeO4装置,KOH溶液过量的原因是_________________________。
(4)D为尾气处理装置,发生反应的离子方程式为___________________________。
【答案】分液漏斗 浓盐酸 饱和食盐水 K2FeO4微溶于KOH溶液,在碱性溶液中较稳定(或有利于生成K2FeO4) Cl2+2OH-=Cl-+ClO-+H2O
【解析】
(1) A为氯气发生装置,由高锰酸钾和浓盐酸反应制取得到Cl2,根据浓盐酸的状态选择仪器;(2)装置B为除杂装置, 反应使用浓盐酸,浓盐酸会挥发产生HCl ,使得产生的Cl2中混有HCl ,需要将混和气体通过饱和食盐水达到除杂的目的;(3)C为制备K2FeO4装置, KOH溶液过量的原因是: K2FeO4微溶于KOH溶液,在碱性溶液中较稳定(或有利于生成K2FeO4);(4)根据Cl2+2NaOH=NaCl+NaClO+H2O 反应书写离子方程式。
(1 ) A为氯气发生装置,由高锰酸钾和浓盐酸反应制取得到Cl2 ,高锰酸钾具有强氧化性,浓盐酸表现为还原性;其中盛放浓盐酸的仪器名称为分液漏斗。答案:分液漏斗;浓盐酸。
(2)装置B为除杂装置,反应使用浓盐酸具有挥发性,会挥发出HCl ,使得产生的Cl2中混有HCl ,HCl可与KOH、Fe(OH)3反应,可用饱和食盐水除去HCl。答案:饱和食盐水。
(3)C为制备K2FeO4装置, K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定,所以KOH溶液要过量,减少副反应发生,有利于生成K2FeO4;答案:K2FeO4微溶于KOH溶液,在碱性溶液中较稳定(或有利于生成K2FeO4)。
(4)D为尾气处理装置,因为Cl2+2NaOH=NaCl+NaClO+H2O ,所以可以通过碱吸收尾气。其反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;答案:Cl2+2OH-=Cl-+ClO-+H2O。

 口算能手系列答案
口算能手系列答案【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请完成此实验设计,其中:V1= ,V2= 。
(2)实验①、②探究的是 对化学反应速率的影响,根据上表中的实验数据,可以得到的结论是_________________________________________________________。
(3)探究温度对化学反应速率的影响,应选择________________(填实验编号)。
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为____________________。
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
①该小组同学提出的假设是________________________________________________。
②若该小组同学提出的假设成立,应观察到________________________________现象。




