题目内容
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
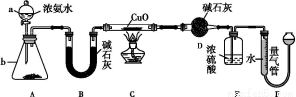
(1)仪器a的名称为 ;仪器b中可选择的试剂为 。
(2)实验室中,利用装置A,还可制取的无色气体是 (填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体产生,上述现象证明NH3具有 性,写出相应的化学方程式: 。
(4)E装置中浓硫酸的作用是 。
(5)读取气体体积前,应对装置F进行的操作: 。
(6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为 (用含m、n字母的代数式表示)。
(1)分液漏斗 氧化钙或氢氧化钠固体或碱石灰
(2)BC (3)还原 3CuO+2NH3 3Cu+3H2O+N2
3Cu+3H2O+N2
(4)吸收未反应的氨气,阻止F中水蒸气进入D
(5)慢慢上下移动右边漏斗,使左右两管液面相平
(6)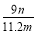
【解析】(1)仪器a是分液漏斗,浓氨水可以与生石灰、氢氧化钠固体、碱石灰等制取氨气。
(2)装置A是一种固体+液体反应不需要加热的气体发生装置,可以用来制取H2、CO2、NO2等,还可以用H2O2与MnO2来制取O2,这里注明是无色气体,则不能是NO2。
(3)黑色CuO粉末变为红色固体,说明黑色的CuO被还原为Cu,同时NH3被氧化为N2,证明了NH3具有还原性:2NH3+3CuO 3Cu+N2+3H2O。
3Cu+N2+3H2O。
(4)实验需要通过称量D装置反应前后的质量差来作为氨气中氢原子物质的量的计算依据,所以E装置具有隔离D与F的作用,防止F中的水蒸气进入D中,同时可以把未反应的NH3吸收掉。
(5)测定量气管收集气体体积时要保证装置内气体压强与大气压相等,所以需要是两管液面相平。
(6)D增重是吸收了NH3还原CuO生成的水的质量,
n(H)=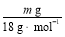 ×2=
×2=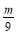 mol,
mol,
n(N)=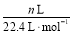 ×2=
×2=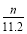 mol。
mol。
所以氨分子中氮、氢的原子个数比为: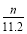 ∶
∶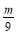 =
=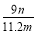 。
。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案某化学研究性学习小组对硫酸铜分解气体产物的成分进行如下探究:
【查阅资料】
硫酸铜受热分解生成氧化铜和气体,温度不同时,气体可能为SO3,SO2和O2中的一种、两种或三种。
【提出假设】
假设1:气体产物只有一种;
假设2:气体产物只有两种;
假设3:气体产物有三种。
(1)若假设1成立,则产物气体的成分是 ;若假设2成立,则产物气体的成分是 。
【实验及结果讨论】
(2)甲同学将分解生成的气体依次通过盛浓硫酸和KMnO4酸性溶液的洗气瓶,能说明产物气体中含SO2的现象是 ,该现象说明SO2具有的性质是 ,实验中还发现盛浓硫酸的洗气瓶质量明显增加,原因是 。
(3)乙同学将分解生成的气体通过碱石灰后,再收集测定剩余气体的体积,在不同温度下进行3组实验。请完成下表(实验中硫酸铜均完全分解):
实验 序号 | 称取CuSO4 的质量/g | 碱石灰的 增加质量/g | 剩余气体的体积(折算 成标准状况下)/mL | 结论 |
Ⅰ | 6.4 |
|
| 假设1成立 |
Ⅱ | 6.4 | 2.88 | 224 |
|
Ⅲ | 6.4 | 2.56 | 448 |
|