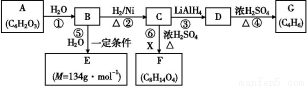
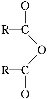
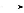题目内容
磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性,制备时将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径在36~55 nm的磁流体。下列说法中正确的是( )
A.所得的分散系属于悬浊液
B.该分散系能产生丁达尔效应
C.所得的分散系中分散质为Fe2O3
D.所得分散系为胶体,且胶粒直径即为氢氧化铁分子直径
B
【解析】经分析可知:分散质粒子直径在36~55 nm的磁流体,符合胶体粒子直径的范围,故该分散系能产生丁达尔效应,不属于悬浊液,A错误,B正确。磁流体由FeSO4和Fe(SO4)3 制备,所以胶粒中有Fe2O3、FeO,如果仅仅为Fe2O3,胶体不会呈黑色,C错误。胶粒是许多个氢氧化铁分子的集合体,D错误。

某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是 。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
试管 | 操作 | 现象 |
① | 先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
② | 先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为 。
同学乙认为应该补充实验,才能得出同学甲的结论。请你帮助同学乙完成实验:
实验2:
操作 | 应该观察到的现象 |
|
|
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
实验3:进行实验以确定可能的原因。
操作 | 现象 |
向试管②所得溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间后。取出上层溶液,滴加KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN溶液后,出现浅红色 |
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
操作 | 现象 |
向另一支试管中加入2 mL FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
你认为实验4设计的主要目的是 。
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,用原子结构解释原因: 。