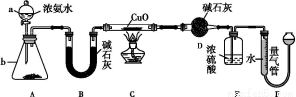
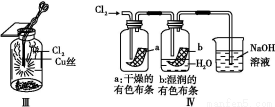
题目内容
某化学研究性学习小组对硫酸铜分解气体产物的成分进行如下探究:
【查阅资料】
硫酸铜受热分解生成氧化铜和气体,温度不同时,气体可能为SO3,SO2和O2中的一种、两种或三种。
【提出假设】
假设1:气体产物只有一种;
假设2:气体产物只有两种;
假设3:气体产物有三种。
(1)若假设1成立,则产物气体的成分是 ;若假设2成立,则产物气体的成分是 。
【实验及结果讨论】
(2)甲同学将分解生成的气体依次通过盛浓硫酸和KMnO4酸性溶液的洗气瓶,能说明产物气体中含SO2的现象是 ,该现象说明SO2具有的性质是 ,实验中还发现盛浓硫酸的洗气瓶质量明显增加,原因是 。
(3)乙同学将分解生成的气体通过碱石灰后,再收集测定剩余气体的体积,在不同温度下进行3组实验。请完成下表(实验中硫酸铜均完全分解):
实验 序号 | 称取CuSO4 的质量/g | 碱石灰的 增加质量/g | 剩余气体的体积(折算 成标准状况下)/mL | 结论 |
Ⅰ | 6.4 |
|
| 假设1成立 |
Ⅱ | 6.4 | 2.88 | 224 |
|
Ⅲ | 6.4 | 2.56 | 448 |
|
(1)SO3 SO2和O2
(2)高锰酸钾酸性溶液颜色变浅或褪色 还原性 浓硫酸吸收了SO3
(3)
|
|
|
|
|
|
| 3.2 | 0 |
|
|
|
|
| 假设3成立 |
|
|
|
| 假设2成立 |
【解析】(1)若CuSO4分解在生成CuO的同时,只生成一种气体,则此过程定为非氧化还原反应,此气体只能是SO3;若生成两种气体,则此过程必为氧化还原反应,有SO2生成必有O2生成;(2)SO2能使酸性KMnO4溶液褪色;浓H2SO4除了吸收H2O(g)质量增加外,还可吸收SO3。(3)乙同学实验中,n(CuSO4)=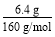 =0.04 mol,若假设1成立,则n(SO3)=0.04 mol,无其他气体生成,所以碱石灰增重即吸收SO3的质量:0.04 mol×80 g·mol-1=3.2 g,剩余气体体积为0;Ⅱ中,n(O2)=
=0.04 mol,若假设1成立,则n(SO3)=0.04 mol,无其他气体生成,所以碱石灰增重即吸收SO3的质量:0.04 mol×80 g·mol-1=3.2 g,剩余气体体积为0;Ⅱ中,n(O2)=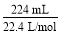 =0.01 mol,由2SO3
=0.01 mol,由2SO3 2SO2+O2知:n(SO3)=0.02 mol,再由S原子守恒:知n(SO2)=0.04 mol-0.02 mol=0.02 mol,假设3成立;Ⅲ中,n(O2)=
2SO2+O2知:n(SO3)=0.02 mol,再由S原子守恒:知n(SO2)=0.04 mol-0.02 mol=0.02 mol,假设3成立;Ⅲ中,n(O2)= 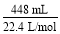 =0.02 mol,则n(SO2)=0.04 mol,由S原子守恒知:此时无SO3生成,则假设2成立。
=0.02 mol,则n(SO2)=0.04 mol,由S原子守恒知:此时无SO3生成,则假设2成立。

某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是 。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
试管 | 操作 | 现象 |
① | 先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
② | 先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为 。
同学乙认为应该补充实验,才能得出同学甲的结论。请你帮助同学乙完成实验:
实验2:
操作 | 应该观察到的现象 |
|
|
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
实验3:进行实验以确定可能的原因。
操作 | 现象 |
向试管②所得溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间后。取出上层溶液,滴加KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN溶液后,出现浅红色 |
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
操作 | 现象 |
向另一支试管中加入2 mL FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
你认为实验4设计的主要目的是 。
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,用原子结构解释原因: 。