��Ŀ����
����Ŀ������[KAl(SO4) 2 ��12H2O]������ˮ�����������Ҵ������������������й㷺��;�������������ķ����������ң���Al��Al2O3��������SiO2��FeO��xFe2O3���Ʊ������Ĺ����������£�

�ش��������⣺
��1�����ʱΪ������Ľ�ȡ�ʣ��ɲ�ȡ�Ĵ�ʩ��_________�����ţ���
a������ͬŨ�ȵ����� b���������ν�ȡ
c����ȡʱ������һ�� d���ʵ������¶�
��2������1�ijɷ���__________������2�������������Ƶ�һ�ָ�Ч�����߷��ӻ��������仯ѧʽΪ[Fe2(OH)n(SO4)(3-0.5n)]m�������������Ԫ�صĻ��ϼ�Ϊ___________��
��3��������ҺA�к���Fe2+��ʵ�鷽����������________________________________________��
��4����֪������Ksp[Fe(OH)3]=4.0��10-38����������Һ��pH=3ʱ����Һ��c(Fe3+)=____________��
��5���������а�������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����Ȳ�����ʹ�þƾ�ϴ�����������Ŀ����___________________________________________________________________��������ˮ��ԭ����_______________________________________��д���ӷ���ʽ����
��6����֪��pH=3�ͼ��������£�MnO4-����Mn2+��Ӧ����MnO2������������ͼ�м�������MnSO4������Ӧ�����ӷ���ʽΪ_________________________��
���𰸡� bd SiO2 +3 ȡ������ҺA���Թ��У����뼸�����Ը��������Һ�����������Һ��ɫ��˵����ҺA�к���Fe2+����ȡ������ҺA���Թ��У����뼸�����軯����Һ��������ɫ������˵����ҺA�к���Fe2+�� 4.0��10-5 mol��L-1 �����Ҵ����ӷ��Դ���ˮ�֣�ʹ������ٱ�� Al3++3H2O![]() Al(OH)3�����壩+3H+ 3Mn2++2MnO
Al(OH)3�����壩+3H+ 3Mn2++2MnO![]() +2H2O=5MnO2��+4H+
+2H2O=5MnO2��+4H+
�����������ң���Al��Al2O3��������SiO2��FeO��xFe2O3�����������ϡ�������ܹ��ˣ���ҺΪ��������������������������������Ϊ��������Ͳ��������ʣ���ҺA�м����Թ������������Һ������������Ϊ�����ӣ�������ҺpHʹ������ȫ�������������Ӳ��������������������̳�ȥ�����ĸ�����������˵õ��������̹��������������������Һ��Ҫ����������Һ���������������Ũ������ȴ�ᾧ��������ϴ��������õ��������ؾ��壻��
��1��a������ͬŨ�ȵ�������������������������a����b���������ν�ȡ��������Ľ�ȡ�ʣ�b��ȷ��c����ȡʱ������һ�벻��������Ľ�ȡ�ʣ�c������d���ʵ������¶ȿ�������Ľ�ȡ�ʣ�d��ȷ����ѡbd����2���������Ϸ�����֪����1�ijɷ���SiO2�����ݻ������������۴�����Ϊ0��֪����������Ԫ�صĻ��ϼ�Ϊ![]() ������3���������������ø��������Һ�����軯����Һ��ʵ�����Ϊ��ȡ������ҺA���Թ��У����뼸�����Ը��������Һ�����������Һ��ɫ��˵����ҺA�к���Fe2+����ȡ������ҺA���Թ��У����뼸�����軯����Һ��������ɫ������˵����ҺA�к���Fe2+������4����Һ��pH=3ʱ��������Ũ����1��10��11mol/L������������������ܶȻ�������֪��Һ��c(Fe3+)��
������3���������������ø��������Һ�����軯����Һ��ʵ�����Ϊ��ȡ������ҺA���Թ��У����뼸�����Ը��������Һ�����������Һ��ɫ��˵����ҺA�к���Fe2+����ȡ������ҺA���Թ��У����뼸�����軯����Һ��������ɫ������˵����ҺA�к���Fe2+������4����Һ��pH=3ʱ��������Ũ����1��10��11mol/L������������������ܶȻ�������֪��Һ��c(Fe3+)��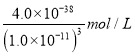 ��4.0��10��5mol/L����5�������Ҵ����л��ܼ���ˮ���ܣ����ӷ�������ʹ�þƾ�ϴ�����������Ŀ���������Ҵ����ӷ��Դ���ˮ�֣�ʹ������ٱ�ɣ���������ˮ������ˮ�����������������������������ʵ����ö���ˮ����Ӧ�����ӷ���ʽΪ��Al3++3H2O
��4.0��10��5mol/L����5�������Ҵ����л��ܼ���ˮ���ܣ����ӷ�������ʹ�þƾ�ϴ�����������Ŀ���������Ҵ����ӷ��Դ���ˮ�֣�ʹ������ٱ�ɣ���������ˮ������ˮ�����������������������������ʵ����ö���ˮ����Ӧ�����ӷ���ʽΪ��Al3++3H2O![]() Al(OH)3�����壩+3H+����6����pH=3�����������£�MnO4������Mn2+��Ӧ����MnO2����˼���MnSO4������Ӧ�����ӷ���ʽΪ��3Mn2++2MnO4��+2H2O��5MnO2��+4H+��
Al(OH)3�����壩+3H+����6����pH=3�����������£�MnO4������Mn2+��Ӧ����MnO2����˼���MnSO4������Ӧ�����ӷ���ʽΪ��3Mn2++2MnO4��+2H2O��5MnO2��+4H+��

 ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д� Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�