题目内容
下列事实不能用电化学原理解释的是( )
| A.镀锌铁片比镀锡铁片更耐腐蚀 |
| B.远洋海轮的尾部装上一定数量的锌板 |
| C.常温条件下,在空气中铝不易被腐蚀 |
| D.用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜 |
C
解析试题分析:A.由于金属活动性Zn>Fe>Sn,所以镀锌铁片镀层破坏后Zn作原电池的负极,仍然会对铁起到保护作用,而镀锡铁片镀层破损后Fe作原电池的负极,会加速对铁的腐蚀,因此镀锌铁片比镀锡铁片更耐腐蚀,正确;B.远洋海轮的尾部装上一定数量的锌板,就可以因为原电池反应消耗Zn,从而保护了海轮,正确;C.常温条件下,在空气中铝不易被腐蚀,是由于Al被氧化而产生了一层致密的氧化物保护膜而阻止了反应的进一步发生,与原电池反应无关,错误;D.用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜,Zn与硫酸铜在溶液中就会发生置换反应产生Cu,构成Cu、Zn 原电池,Zn作负极,一层大大加快了反应速率,正确。
考点:考查原电池反应的应用的知识。

如图所示的装置中,金属a能从酸中置换出H2,b为碳棒,关于此装置的各种叙述中不正确的是( )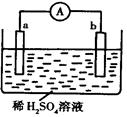
| A.碳棒上有气体放出,溶液pH值变大 |
| B.a是正极,b是负极 |
| C.导线中有电子流动,电子从a极到b极 |
| D.a极上发生了氧化反应 |
美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H+)溶剂,在200oC左右供电。电池总反应为:C2H5OH+3O2→2CO2+3H2O,下图是该电池的示意图,下列说法正确的是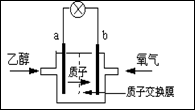
| A.a极为电池的正极 |
| B.电池工作时电流由a极沿导线经灯泡再到b极 |
| C.电池正极的电极反应为:4H+ + O2 + 4e-=2H2O |
| D.电池工作时,1mol乙醇被氧化时就有6mol电子转移 |
一个原电池的总反应的离子方程式是:Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是
| | 正极 | 负极 | 电解质溶液 |
| A | Zn | Cu | CuCl2 |
| B | Zn | Cu | ZnCl2 |
| C | Cu | Zn | CuSO4 |
| D | Cu | Zn | ZnSO4 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s) ,下列说法错误的是( )
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据电镀原理,钢芯镀镍时,钢芯应该做
| A.正极 | B.负极 | C.阳极 | D.阴极 |
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁做电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )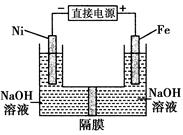
| A.铁是阳极,电极反应为Fe-6e-+4H2O===FeO+8H+ |
| B.镍电极上的电极反应为2H2O+2e-==H2↑+2OH- |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,最终溶液pH不变 |
某同学做完铜、锌稀硫酸原电池的实验后得出了下列结论,你认为正确的是
| A.构成原电池正极和负极的材料必须是两种金属 |
| B.当由铜、锌电极与硫酸铜溶液组成原电池时,铜是负极 |
| C.该实验电子沿导线由锌流向铜,氢离子得到电子而放出氢气 |
| D.铜锌原电池工作时,电流由锌经导线流向铜 |