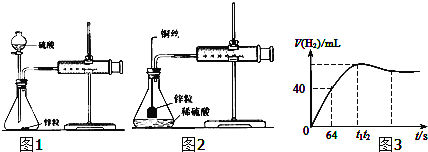
题目内容
【题目】将NO2、O2和熔融KNO3制成燃料电池,电解处理含Cr2O72-的废水。电解过程中发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。下列说法正确的是( )

A.石墨Ⅱ是电池的负极
B.若溶液中减少了0.01molCr2O72-,则电路中至少转移了0.12mol电子
C.Fe(a)棒上发生的电极反应为:Fe-3e-=Fe3+
D.在相同条件下,消耗的O2和NO2的体积比为4∶1
【答案】B
【解析】
A.左边的电池为原电池,其中通入NO2的石墨电极I为负极,NO2失去电子变为N2O5,右边的石墨电极II为原电池的正极,A错误;
B.若溶液中减少了0.01molCr2O72-,由于反应后Cr2O72-得到电子变为Cr3+,每1mol Cr2O72-获得6mol电子,则溶液中减少了0.01molCr2O72-,电路中转移电子的物质的量为0.06mol,此时阳极中产生的0.06molFe2+转化为Fe3+,又转移电子0.06mol,反应开始时阳极有0.06mol的Fe失去电子,转化为Fe2+,故转移电子的物质的量最少为0.12mol,B正确;
C.Fe(a)棒接电源正极,为阳极,阳极Fe(a)上Fe失去电子,发生氧化反应,发生的电极反应为:Fe-2e-=Fe2+,C错误;
D.1molO2得到4mol电子,1molNO2反应会失去1mol电子,在同一闭合回路中电子转移数目相等,则在相同条件下,消耗的O2和NO2的体积比为1∶4,D错误;
故合理选项是B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置图和有关数据如下:
相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
苯甲酸钠 | 144 | — | 249.3 | 易溶于水 |
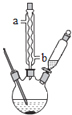
按下列合成步骤回答问题:
(1)制备苯甲酸
在三颈瓶中加入4mL甲苯和20mL蒸馏水,再加入5mL浓硫酸,放入碎瓷片后,加热至沸腾,加入![]() 高锰酸钾,加热到甲苯层消失。将三颈瓶在冰水浴中冷却,分离出苯甲酸.
高锰酸钾,加热到甲苯层消失。将三颈瓶在冰水浴中冷却,分离出苯甲酸.
(2)制备苯甲酸钠
控制温度为70℃,向三颈瓶中加入![]() 苯甲酸和适量的
苯甲酸和适量的![]() 的碳酸钠溶液,充分反应后停止加热.在深色的溶液中加入活性炭,并将反应混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体.
的碳酸钠溶液,充分反应后停止加热.在深色的溶液中加入活性炭,并将反应混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体.
①球形冷凝管的作用是 ______ ,其进水口是 ______ ![]() 填“a”或“b”
填“a”或“b”![]() .
.
②三颈瓶中反应的离子方程式 ______ .
③分离苯甲酸选用的玻璃仪器是 ______ ![]() 填标号
填标号![]()
A分液漏斗B玻璃棒C烧杯D漏斗E蒸馏烧瓶F直形冷凝管
④分离出的苯甲酸晶体中可能含有的杂质是 ______ ,为进一步提纯,应采用的方法是 ______ .
⑤控制温度为70℃的方法是 ______ .
⑥加入活性炭的作用是 ______ .