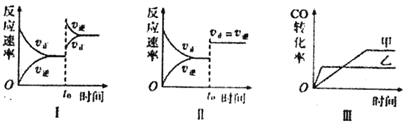
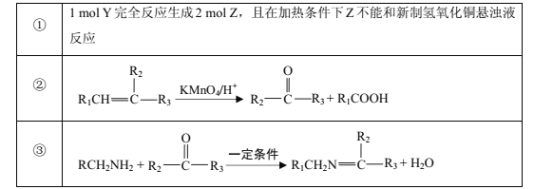
题目内容
【题目】苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置图和有关数据如下:
相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
苯甲酸钠 | 144 | — | 249.3 | 易溶于水 |
按下列合成步骤回答问题:
(1)制备苯甲酸
在三颈瓶中加入4mL甲苯和20mL蒸馏水,再加入5mL浓硫酸,放入碎瓷片后,加热至沸腾,加入![]() 高锰酸钾,加热到甲苯层消失。将三颈瓶在冰水浴中冷却,分离出苯甲酸.
高锰酸钾,加热到甲苯层消失。将三颈瓶在冰水浴中冷却,分离出苯甲酸.
(2)制备苯甲酸钠
控制温度为70℃,向三颈瓶中加入![]() 苯甲酸和适量的
苯甲酸和适量的![]() 的碳酸钠溶液,充分反应后停止加热.在深色的溶液中加入活性炭,并将反应混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体.
的碳酸钠溶液,充分反应后停止加热.在深色的溶液中加入活性炭,并将反应混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体.
①球形冷凝管的作用是 ______ ,其进水口是 ______ ![]() 填“a”或“b”
填“a”或“b”![]() .
.
②三颈瓶中反应的离子方程式 ______ .
③分离苯甲酸选用的玻璃仪器是 ______ ![]() 填标号
填标号![]()
A分液漏斗B玻璃棒C烧杯D漏斗E蒸馏烧瓶F直形冷凝管
④分离出的苯甲酸晶体中可能含有的杂质是 ______ ,为进一步提纯,应采用的方法是 ______ .
⑤控制温度为70℃的方法是 ______ .
⑥加入活性炭的作用是 ______ .
【答案】冷凝回流 b 5![]() +6MnO4-+18H+→5
+6MnO4-+18H+→5![]() +6Mn2++14H2O BCD
+6Mn2++14H2O BCD ![]() 、
、![]() 重结晶 水浴加热 吸附色素或脱色
重结晶 水浴加热 吸附色素或脱色
【解析】
本实验制备苯甲酸及其盐的思路为:用高锰酸钾在酸性条件下将甲苯氧化成苯甲酸,分离出来后再用碳酸钠溶液使之转化成苯甲酸钠,通过分离提纯操作制得苯甲酸钠晶体。在明确实验目的和思路的基础上,结合实验相关知识,可解各小题。
①球形冷凝管的作用是冷凝回流,减少反应物的损失,水流为下进上出,所以进水口是b。答案为:冷凝回流;b;
②本实验是制取苯甲酸,利用酸性高锰酸钾的强氧化性,把甲苯上的甲基氧化成羧基,本身被还原成Mn2+,根据化合价的升降配平,甲苯失去2个H并增加2个O,化合价升高6,Mn化合价从+7降低为+2,降低5,故甲苯和![]() 按5:6反应,可写出反应方程式为:5
按5:6反应,可写出反应方程式为:5![]() +6
+6![]() +18H+→5
+18H+→5![]() +6Mn2++14H2O。答案为:5
+6Mn2++14H2O。答案为:5![]() +6
+6![]() +18H+→5
+18H+→5![]() +6Mn2++14H2O;
+6Mn2++14H2O;
③根据表格数据,苯甲酸在此状态下是微溶于水的固体,因此采用过滤的方法进行分离,用到的仪器有:烧杯、玻璃棒、漏斗、滤纸、铁架台等,因此B、C、D正确;答案为:BCD;
④根据②中反应的离子方程式,得出混有的杂质是K2SO4、MnSO4,这两种物质溶于水,采取再溶解,再结晶的方法,即重结晶法;答案为:K2SO4、MnSO4;重结晶;
⑤温度控制在70℃,如果直接加热,温度很容易超过70℃,因此采取水浴加热,优点是:受热均匀,便于控制温度;答案为:水浴加热;
⑥根据信息,深色溶液中加入活性炭,得到无色透明溶液,且活性炭具有吸附性,因此活性炭的作用是吸附脱色;答案为:吸附色素或脱色。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
CO(g)+2H2(g)CH3OH(g) ΔH2=-90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式:_______。
(2)为提高CH3OH产率,理论上应采用的条件是_______(填字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),如图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。

反应物X是_______(填“CO2”或“H2”)。
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
D | 553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用CO2生产甲醇的最优选项为_______(填字母)。
(5)已知气相直接水合法可以制取乙醇:H2O(g)+C2H4(g)CH3CH2OH(g)。当n(H2O):n(C2H4)=1

①图中压强p1、p2、p3、p4的大小顺序为:_______,理由是:_______。
②气相直接水合法采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9 MPa,n(H2O):n(C2H4)=0.6:1。该条件下乙烯的转化率为5%。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有_______、_______。
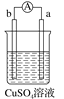
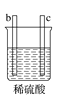
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置 |
|
|
部分实验现象 | a极质量减小b极质量增加 | b极有气泡产生c极无变化 |
实验装置 |
|
|
部分实验现象 | d极溶解c极有气泡产生 | 电流从a极流向d极 |
由此判断这四种金属的活动性顺序是( )
A. a>b>c>dB. d>a>b>cC. b>c>d>aD. a>b>d>c