题目内容
【题目】节能减排措施是我国“十一五”期间提出的政策措施。
(1)煤的燃烧,会产生大量有害气体。将煤转化为水煤气,可有效降低排放。
C(s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
H2(g)+ ![]() O2(g)=H2O(g) △H=-242.0kJ·mol-1
O2(g)=H2O(g) △H=-242.0kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式____________。
(2)汽车尾气的排放是大气污染物的重要来源,其中含有NO气体。根据资料显示用活性炭还原法可以处理氮氧化物,某硏究小组向固定容积的密闭容器中加入一定量的活性炭和NO发生反应C(s)+2NO(g)![]() CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:
CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:
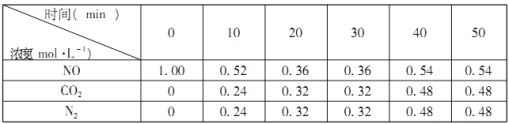
①0到10min内,NO的平均反应速率v(NO)=___________mol·L-1·min-1。
②下列数据不再变化可表示该反应达到平衡的是________________________。
a.容器内压强 b.混合气体的平均摩尔质量 c.混合气体的密度
③若容器改为可变容积容器,达平衡后,再充入少量NO气体,再次达到平衡时N2的浓度 ____________(填“增大”,“减小”,或“不变”)
(3)在某温度T时能同时发生反应:
2N2O5(g)![]() 2N2O4(g)+O2(g) K1
2N2O4(g)+O2(g) K1
N2O4(g)![]() 2NO2(g) K2
2NO2(g) K2
若向一体积固定为2L的密闭容器内加入N2O5 2mol,一段时间后,容器内的反应达到平衡,此时n(NO2)=0.4mol,已知K2=0.1,请计算出K1=___________。
【答案】C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5kJ·mol-1 0.048 bc 不变 0.16
【解析】
(1)①C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1
②H2(g)+ ![]() O2(g)=H2O(g) △H=-242.0kJ·mol-1
O2(g)=H2O(g) △H=-242.0kJ·mol-1
③CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
根据盖斯定律①-②-③可得;
(2)①根据v=c÷t计算;
②根据平衡状态特征分析;
③根据压强对反应的影响可得;
(3)一体积固定为2L的密闭容器,容器内的反应达到平衡,此时n(NO2)=0.4mol,c(NO2)=0.2mol/L,已知K2=0.1,则容器中有c2(NO2)÷c(N2O4)=0.1,可得c(N2O4)=0.4mol/L,根据反应N2O4(g)2NO2(g)得到0.2mol/L的NO2则消耗N2O40.1mol/L,则由反应2N2O5(g)2N2O4(g)+O2(g)生成的N2O4有0.5mol/L,再根据反应解得各物质的浓度,计算K1;
(1)①C(s)+O2(g)=CO2(g)△H=393.5kJmol1
②H2(g)+ ![]() O2(g)=H2O(g) △H=-242.0kJ·mol-1
O2(g)=H2O(g) △H=-242.0kJ·mol-1
③CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
根据盖斯定律①②③得C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5kJ·mol-1;
故答案为:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5kJ·mol-1;
(2)①0到10min内,NO的平均反应速率v(NO)=(1.00mol/L0.52mol/L)÷10min=0.048 mol·L-1·min-1;
故答案为:0.048;
②a.反应C(s)+2NO(g)![]() CO2(g)+N2(g)是个气体体积不变的反应,容器内压强始终保持不变,故a错误;
CO2(g)+N2(g)是个气体体积不变的反应,容器内压强始终保持不变,故a错误;
b.根据M=m混÷n,混合气体的质量增大,n不变,平均摩尔质量增大,混合气体平均摩尔质量不变时达到平衡,故b正确;
c.跟ρ=m混÷V,混合气体的质量增大,体积不变,混合气体的密度增大,混合气体的密度时达到平衡,故c正确;
故答案为:bc;
③若容器改为可变容积容器达平衡后改变某一条件,一段时间后,反应再次达到原平衡,因为反应是个气体体积不变的反应,故压强对其平衡无影响,故可以是增加NO浓度;
故答案为:增加NO浓度;
(3) 一体积固定为2L的密闭容器,容器内的反应达到平衡,此时n(NO2)=0.4mol,c(NO2)=0.2mol/L,已知K2=0.1,则容器中有c2(NO2)÷c(N2O4)=0.1,
可得c(N2O4)=0.4mol/L,根据反应N2O4(g)2NO2(g)得到0.2mol/L的NO2则消耗N2O40.1mol/L,则由反应2N2O5(g
故答案为:0.16;

 每课必练系列答案
每课必练系列答案【题目】锌锰干电池是最早使用的化学电池,其基本构造如图1所示:
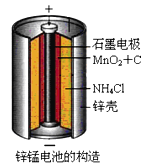
![]()
(1)锌锰干电池的电路中每通过![]() ,理论上负极质量减少 ______ g;工作时
,理论上负极质量减少 ______ g;工作时![]() 离子在正极放电产生两种气体,其中一种气体分子是含
离子在正极放电产生两种气体,其中一种气体分子是含![]() 的微粒,正极的电极反应式是 ______
的微粒,正极的电极反应式是 ______
(2)某研究小组对电池内黑色糊状物进行了下列实验:
已知:![]() 是两性氢氧化物,完成下列实验报告:
是两性氢氧化物,完成下列实验报告:
实验步骤 | 实验现象 | 实验结论和解释 |
取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, ______ | 无色溶液中存在 检验 |
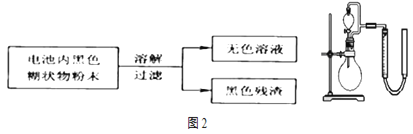
(3)利用残渣中分离出的![]() ,研究其在
,研究其在![]() 制
制![]() 过程中的作用.实验装置如图2所示。将等物质的量浓度、等体积
过程中的作用.实验装置如图2所示。将等物质的量浓度、等体积![]() 溶液加入烧瓶中,分别进行2个实验
溶液加入烧瓶中,分别进行2个实验![]() 气体的体积在相同条件下测定
气体的体积在相同条件下测定![]() 。
。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
实验一 | 足量 | 收集到56mL气体 |
|
实验二 | 足量 | 黑色粉末部分溶解,收集到112mL气体 |
|
实验1、2中参加反应的![]() 的物质的量之比为 ______ ,实验二中反应的离子方程式为 ______。
的物质的量之比为 ______ ,实验二中反应的离子方程式为 ______。

