题目内容
18.实验室需要配制90ml1.00mol/L的NaCl溶液.请回答:(1)用托盘天平应称取NaCl5.9g,当1g以下用游码,某同学将药品和砝码放调时,称其质量为4.1g.
(2)此实验过程中要进行定容操作,请阐述详细操作方法:加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切
(3)在操作过程中出现下列情况,造成测定结果偏高的是DE
A.转移溶液前,容量瓶未干燥
B.称取NaCl时,发现NaCl已潮湿
C.转移溶液时,有部分溅出
D.定容时,俯视观察容量瓶标线
E.称取NaCl时,发现砝码已生锈
(4)此实验所用容量瓶的外壁上注明的数字及单位是100mL.
分析 (1)根据n=cV、m=nM计算出需要氯化钠的质量,注意托盘天平的最小读数为0.1g;
(2)加水至刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
(3)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)容量瓶只有一个刻度.
解答 解:(1)没有90mL的容量瓶,应配制100mL溶液,100mL、1mol/L的NaCl中含有氯化钠的质量为:58.5g/mol×1mol/L×0.1L=5.85g,托盘天平最小读数为0.1g,需要称量5.9g氯化钠,左码右物时,实际物质的质量=砝码-游码=5-0.9=4.1g,
故答案为:5.9;4.1;
(2)加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切,故答案为:加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
(3)A.容量瓶未干燥即用来配制溶液,都溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度不变;
B.NaCl已潮湿称取氯化钠的质量偏小,浓度偏低;
C.部分溅出,溶质的物质的量减小,浓度偏低;
D.定容时仰视刻度线,导致溶液的体积偏大,溶液的浓度偏小;
E.称量用了生锈的砝码,导致称取的溶质的质量偏大,溶质的物质的量偏大,溶液的浓度偏大;
故答案为:DE;
(4)容量瓶只有一个刻度,应选用100mL的容量瓶,故答案为:100mL.
点评 本题考查了配制一定物质的量浓度的溶液方法,题目难度不大,注意掌握配制一定物质的量浓度的溶液步骤,(1)为易错点,注意托盘天平的最小读数为0.1g.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
8.常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7,下列关于滤液中的浓度关系正确的是( )
| A. | $\frac{{K}_{w}}{c({H}^{+})}$>1.0×10-7mol/L | |
| B. | 往滤液中加水稀释,所有离子浓度都会减小 | |
| C. | c(H+)+c(NH4+)═c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-) |
6.下列比较、归纳一定正确的是( )
| A. | 酸性:HClO4>H2CO3>H2SiO3 | B. | 稳定性:HF<H2O<NH3 | ||
| C. | 离子半径:Na+>F->Al3+ | D. | 沸点:HI>HBr>HF |
3.取0.2mol MnO2固体粉末与一定体积的浓盐酸(含溶质0.4mol)共热制取氯气(假设HCl挥发损失不计),下列叙述中正确的是( )
| A. | 反应过程中MnO2作催化剂 | B. | 盐酸未反应完 | ||
| C. | 被还原的HCl少于0.2mol | D. | 反应产生2.24L氯气(标准状况) |
10.下列叙述正确的是( )
| A. | NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=3:1时,溶液中无HCO${\;}_{3}^{-}$ | |
| B. | CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 | |
| C. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=5:1时,铝元素以AlO${\;}_{2}^{-}$形式存在 | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:1时,溶液中只有Fe3+存在 |
7.在下列氧化还原反应中,水作还原剂的是( )
| A. | C+H2O$\frac{\underline{\;高温\;}}{\;}$ CO+H2 | B. | 2K+2H2O═2KOH+H2↑ | ||
| C. | 2F2+2H2O═4HF+O2 | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
8.CoCl2•6H2O是一种饲料营养强化剂.工业上利用水钴矿〔主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等〕制取CoCl2•6H2O的工艺流程如下:
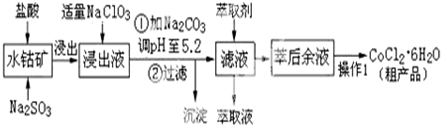
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)水钴矿进行预处理时加入Na2SO3的主要作用是还原Co3+.
(2)写出NaClO3在浸出液中发生主要反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;;若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(4)浸出液加Na2CO3调pH至5.2时,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(5)萃取剂的作用是除去溶液中的Mn2+;.
(6)为测定粗产品中CoCl2•6H2O的含量,称取16.4克的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤,将沉淀烘干后称其质量为4.6克.则粗产品中CoCl2•6H2O的质量分数是93.0%.

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)水钴矿进行预处理时加入Na2SO3的主要作用是还原Co3+.
(2)写出NaClO3在浸出液中发生主要反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;;若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(4)浸出液加Na2CO3调pH至5.2时,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(5)萃取剂的作用是除去溶液中的Mn2+;.
(6)为测定粗产品中CoCl2•6H2O的含量,称取16.4克的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤,将沉淀烘干后称其质量为4.6克.则粗产品中CoCl2•6H2O的质量分数是93.0%.
 实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O