题目内容
【题目】已知甲、乙、丙三种物质均含有同种元素X,其转化关系如下:
![]()
下列说法错误的是
A.若A为NaOH溶液,乙为白色沉淀,则X可能为短周期金属元素
B.若A为硝酸,X为金属元素,则甲与乙反应可生成丙
C.若A为氧气,丙在通常状况下为红棕色气体,则甲可能为非金属单质
D.若乙为NaHCO3,则甲或丙可能是CO2
【答案】B
【解析】
A、若A为NaOH溶液,甲是AlCl3,乙是Al(OH)3白色沉淀,丙是NaAlO2,X为短周期金属元素铝,符合题意,A正确;
B、若A为硝酸,X为金属元素,X应是变价金属,则甲是Fe,乙是Fe(NO3)2,丙是Fe(NO3)3,甲与乙不反应,B错误;
C、若A为氧气,丙在通常状况下为红棕色气体即NO2,则甲是N2,乙是NO,C正确;
D、若乙为NaHCO3,甲是CO2,A是NaOH,丙是Na2CO3,或者甲是Na2CO3,乙是NaHCO3,A是HCl,丙是CO2,D正确。
答案选B。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】如图中A、B、C、D是同周期或同主族的相邻元素:
D | ||
A | B | C |
(1)已知:A元素的最低价为-3价,它的最高价氧化物含氧56.34%,原子核内中子数比质子数多1个,则A元素原子的质量数为_____。
(2)写出元素符号:A_____,C_____,D____。
(3)A、B、C三种元素最高价氧化物的水化物中酸性最强的是____(填化学式)。
(4)B、D两种元素和氢组成的气态氢化物中稳定性最强的是___,还原性最强的____(填化学式)。
【题目】(1)一定条件下,CO2与1.0mol·L-1NaOH溶液充分反应放出的热量如下表:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | X |
2 | 1.0 | 2.00 | y |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学方程式为_____________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒温容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒温容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表:
温度 t/min | 0 | 40 | 80 | 120 | 160 |
甲(673K) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(T) | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
丙(673K) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
②该反应的△H__________(填序号)
a.大于0 b.小于0 c.等于0 d.不能确定
③丙容器达到平衡时,NO的转化率为__________________。
(3)298K时,NH3·H2O的电离常数Kb=2×10-5,H2CO3的电离常数Kal=4×10-7,Ka2=4×10-11。在NH4HCO3溶液中,c(NH4+)__________c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K的数值(用科学计数法表示)为_____。
NH3·H2O+H2CO3的平衡常数K的数值(用科学计数法表示)为_____。
【题目】雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH=________________。
(2)为减少SO2的排放,常将煤转化为清洁气体燃料:
已知:H2(g)+ ![]() O2(g) =H2O(g) △H= -241.8kJ·mol-1
O2(g) =H2O(g) △H= -241.8kJ·mol-1
C(s)+ ![]() O2(g) =CO(g) △H = -110.5kJ·mol-1
O2(g) =CO(g) △H = -110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:_________________________________________________。
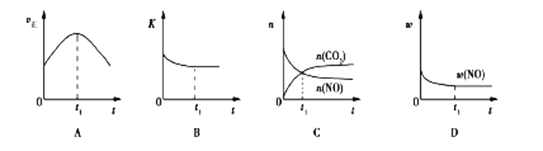
(3)汽车尾气净化的主要原理:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g); △H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
2CO2(g)+N2(g); △H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度/℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式______________________;
②计算上述反应T1℃时的平衡常数K1=______________________;若T1<T2,则该反应的△H _____0(填“>”、“<”或“=”)。
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为________;