题目内容
【题目】雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH=________________。
(2)为减少SO2的排放,常将煤转化为清洁气体燃料:
已知:H2(g)+ ![]() O2(g) =H2O(g) △H= -241.8kJ·mol-1
O2(g) =H2O(g) △H= -241.8kJ·mol-1
C(s)+ ![]() O2(g) =CO(g) △H = -110.5kJ·mol-1
O2(g) =CO(g) △H = -110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:_________________________________________________。
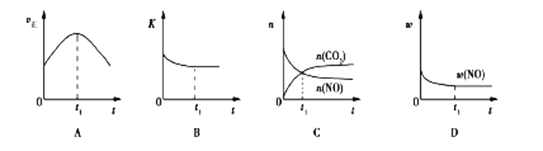
(3)汽车尾气净化的主要原理:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g); △H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
2CO2(g)+N2(g); △H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度/℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式______________________;
②计算上述反应T1℃时的平衡常数K1=______________________;若T1<T2,则该反应的△H _____0(填“>”、“<”或“=”)。
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为________;
【答案】4 C(s)+H2O(g)=CO(g)+H2(g) △H= +131.3 kJmol-1 BD C(s)+2NO(g)=CO2(g)+N2(g) 4 < 80%
【解析】
(1)根据电荷守恒计算溶液中H+的浓度,据此计算溶液的pH值;
(2)焦炭与水蒸气反应的化学方程式为C(s)+H2O(g)=CO(g)+H2(g),再根据盖斯定律计算焓变;
(3)绝热密闭的容器中温度发生变化,影响化学平衡常数,达到化学平衡时,各组分的量不变,正逆反应速率相等,化学平衡常数不发生变化;
(4)①根据反应中物质的转化量之比等于化学计量数之比确定反应物和生成物的系数,再根据元素守恒确定生成物;
②先计算体系中各组分的平衡浓度,再计算平衡常数;结合表格中数据以及温度对平衡移动的影响判断反应热;
③根据等效平衡分析增加NO的量后NO的转化率。
(1)根据电荷守恒,c(K+)+c(Na+)+c(NH4+)+c(H+)=2c(SO42)+c(NO3)+c(Cl),代入数据计算可得c(H+)=1×104mol/L,所以溶液的pH=lgc(H+)=4,故答案为:4;
(2)已知:①H2(g)+![]() O2(g)=H2O(g) △H1= -241.8kJ·mol-1,②C(s)+
O2(g)=H2O(g) △H1= -241.8kJ·mol-1,②C(s)+ ![]() O2(g) =CO(g) △H2= -110.5kJ·mol-1,焦炭与水蒸气反应的化学方程式为C(s)+H2O(g)=CO(g)+H2(g),该反应可由②①得到,根据盖斯定律可得,该反应的焓变△H=△H2△H1=-110.5kJ·mol-1-(-241.8kJ·mol-1)= +131.3 kJmol-1,故答案为:C(s)+H2O(g)=CO(g)+H2(g) △H= +131.3 kJmol-1;
O2(g) =CO(g) △H2= -110.5kJ·mol-1,焦炭与水蒸气反应的化学方程式为C(s)+H2O(g)=CO(g)+H2(g),该反应可由②①得到,根据盖斯定律可得,该反应的焓变△H=△H2△H1=-110.5kJ·mol-1-(-241.8kJ·mol-1)= +131.3 kJmol-1,故答案为:C(s)+H2O(g)=CO(g)+H2(g) △H= +131.3 kJmol-1;
(3)根据反应原理方程式2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H<0,该反应为放热反应,在绝热、恒容容器中进行反应,随着反应进行,温度升高,化学反应速率先加快,后减慢,化学平衡常数减小,
2CO2(g)+N2(g) △H<0,该反应为放热反应,在绝热、恒容容器中进行反应,随着反应进行,温度升高,化学反应速率先加快,后减慢,化学平衡常数减小,
A. 当到达t1时刻时,此时正反应速率最大,当到达化学平衡时,正反应速率应不变,因此不能说明反应到达化学平衡状态,故A不选;
B. 温度改变,则化学平衡常数改变,当到达t1时刻时,此时化学平衡常数不变,可以说明化学反应已经达到化学平衡状态,故B选;
C. 当到达t1时刻时,NO和CO2的物质的量相等,并不能说明化学反应到达平衡状态,化学平衡状态时,应为各物质的物质的量保持不变,故C不选;
D. 当到达t1时刻时,NO的百分含量不变,可以说明化学反应到达化学平衡,故D选;
故答案为:BD;
(4)①在T1温度下,NO和活性炭反应,一定条件下生成气体E和F,根据表格数据分析,达到平衡时,△n(活性炭)=3mol2.96mol=0.04mol,△n(NO)=0.1mol0.02mol=0.08mol,△n(E)=0.04mol,△n(F)=0.04mol,可得C(s)+2NO(g)=E(g)+F(g),根据元素守恒可得NO与活性炭反应的化学方程式为:C(s)+2NO(g)=CO2(g)+N2(g),故答案为:C(s)+2NO(g)=CO2(g)+N2(g);
②T1℃时,体系中各组分的平衡浓度分别为![]() ,
,![]() ,所以该温度下反应的平衡常数为
,所以该温度下反应的平衡常数为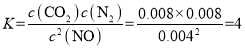 ;若T1<T2,由表格中数据可知,升高温度,反应物的量增多,生成的量减少,说明升高温度,平衡逆向移动,则该反应为放热反应,△H<0,故答案为:4;<;
;若T1<T2,由表格中数据可知,升高温度,反应物的量增多,生成的量减少,说明升高温度,平衡逆向移动,则该反应为放热反应,△H<0,故答案为:4;<;
③反应C(s)+2NO(g)=CO2(g)+N2(g)为反应前后气体分子数不变的反应,即压强变化不对化学平衡产生影响,当该反应平衡后再通入0.1molNO气体,相当于加压,平衡不移动,因此平衡时NO的转化率不变,仍为原平衡时的转化率,即![]() ,故答案为:80%。
,故答案为:80%。

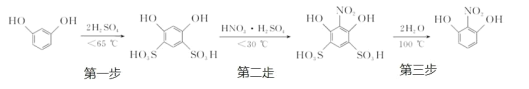
【题目】2-硝基-1,3-苯二酚由间苯二酚先磺化,再硝化,后去磺酸基生成。原理如下:
部分物质的相关性质如下:
名称 | 性状 | 熔点/℃ | 水溶性(常温) |
间苯二酚 | 白色针状晶体 | 110.7 | 易溶 |
2-硝基-1,3-苯二酚 | 桔红色针状晶体 | 87.8 | 难溶 |
制备过程如下:
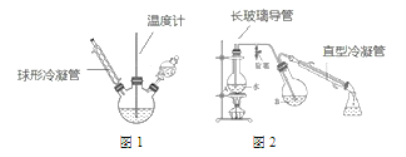
第一步:磺化。称取一定质量的间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内反应 15 min(如图 1)。
第二步:硝化。待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅15 min。第三步:蒸馏。将硝化反应混合物的稀释液转移到圆底烧瓶 B 中,然后用图 2 所示装置进行水蒸气蒸馏,收集馏出物,得到 2-硝基-1,3-苯二酚粗品。
请回答下列问题:
(1)磺化步骤中控制温度最合适的范围为(填字母)________。
a.30 ℃~60 ℃ b.60 ℃~65 ℃ c.65 ℃~70 ℃ d.70 ℃~100 ℃
(2)酚羟基邻对位的氢原子比较活泼,均易被取代,请分析第一步磺化引入磺酸基基团(-SO3H)的作用是_______________________。
(3)硝化步骤中制取“混酸”的具体操作是______________________。
(4)下列说法正确的是_______________。
a 直型冷凝管内壁中可能会有红色晶体析出
b 图 2 中的冷凝管能用图 1 中的冷凝管代替
c 烧瓶A中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能防止压强过小引起倒吸。
(5)蒸馏步骤中,水蒸气蒸馏的作用是__________________。可通过________(填操作)进一步提纯 2-硝基-1,3-苯二酚。