题目内容
【题目】从石油和煤中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来 衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
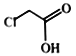
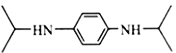
(1)A的结构简式:________;
(2)A使溴的四氯化碳溶液褪色的化学反应方程式:___________;
(3)在碘水中加入B振荡静置后的现象:_______________,该操作叫______________;
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:_________;
反应类型为:_________________;
(5)等质量的A、B完全燃烧时消耗O2的物质的量________(填“A>B”、“A<B”或“A=B”)。
【答案】 CH2=CH2 CH2=CH2+Br2→CH2Br-CH2Br 下层无色,上层紫红色 萃取 ![]() +HO-NO2
+HO-NO2![]()
![]() + H2O 取代反应(或硝化) A>B
+ H2O 取代反应(或硝化) A>B
【解析】A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平,则A为乙烯,B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,则原子个数之比为1:1,最简式为CH,B的相对分子质量为78,设B的分子式为(CH)n,则(12+1)n=78,解得n=6,所以分子式为C6H6,故B为苯。
(1)A为乙烯,其结构简式为:CH2=CH2;
答案为:CH2=CH2;
(2)乙烯使溴的四氯化碳溶液褪色发生加成反应,该反应为CH2=CH2+Br2→CH2Br-CH2Br;
答案为:CH2=CH2+Br2→CH2Br-CH2Br ;
(3)碘水中加入苯发生萃取,苯的密度比水的小,则苯在上层,观察到下层无色,上层紫红色;该操作叫萃取,
答案为:下层无色,上层紫红色;萃取;
(4)B与浓H2SO4与浓HNO3在50-60℃反应的化学反应方程![]() +HO-NO2
+HO-NO2![]()
![]() + H2O ,属于取代反应,也是硝化反应;
+ H2O ,属于取代反应,也是硝化反应;
答案为:![]() +HO-NO2
+HO-NO2![]()
![]() + H2O ;取代反应(或硝化);
+ H2O ;取代反应(或硝化);
(5)乙烯中H元素质量分数比苯中H元素质量分数大,故相同质量的乙烯、苯燃烧,乙烯消耗的氧气更多,即等质量的A、B完全燃烧时消耗O2的物质的量A>B,
故答案为:A>B。

 阅读快车系列答案
阅读快车系列答案【题目】已知 25℃时部分弱电解质的电离平衡常数数据如表:
化学式 | HSCN | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.3×10﹣1 | 1.8×10﹣5 | Ka1=4.3×10﹣1Ka2=5.6×10﹣1 | 3.0×10﹣8 |
回答下列问题:
(1)写出碳酸的主要的电离方程式 . 若将碳酸饱和溶液稀释 10 倍,则稀释后的溶液中 c(H+)原来的十分之一(填“大于”、“小于”或“等于”).
(2)物质的量浓度均为 0.1mol/L 的五种溶液:pH 由小到大的顺序为(用编号填写).
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3 e.NaSCN
(3)25℃时,将 20mL0.1molL﹣1CH COOH 溶液和 20mL0.1molL﹣1HSCN 溶液分别与 20mL0.1molL﹣1NaHCO 溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图.
反应初始阶段两种溶液产生 CO2气体的速率存在明显差异的原因是反应结束后,假设 NaHCO3完全反应且气体全部逸出,则所得两溶液中,c(CH3COO)c(SCN)(填“>”、“<”或“=”)
(4)25℃时,CH3COONa 与 CH3COOH 的混合溶液,若测得 pH=8,则溶液中c(Na+)﹣c(CH3COO﹣)=mol/L(填代入数据后的计算式,不必算出具体数值).
(5)向 NaClO 溶液中通入少量的 CO2 , 发生反应的离子方程式为 .