题目内容
5.从海水中提取的粗盐含有泥沙和Ca2+、Mg2+、SO42-等离子,为制备精盐可使用以下试剂:①Na2CO3溶液 ②BaCl2溶液 ③NaOH溶液.(1)加入试剂的合理顺序是cd(填选项).
a.①②③b.②①③c.③①②d.③②①
(2)加入过量Na2CO3溶液的作用是除去粗盐中的Ca2+和过量的Ba2+.
分析 (1)SO42-、Ca2+、Mg2+分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,所以应先加BaCl2溶液再加Na2CO3溶液,据此进行判断;
(2)加入过量的碳酸钠溶液可以除去钙离子及过量的钡离子.
解答 解:(1)SO42-、Ca2+、Mg2+分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,再通过过滤除去,需要用Na2CO3溶液除去过量的BaCl2,所以应先加BaCl2再加Na2CO3溶液,NaOH溶液的滴加顺序可前可后,则加入试剂的合理顺序可以为:②①③或③②①,即cd正确,
故答案为:cd;
(2)碳酸钠能够与钙离子和钡离子反应生成沉淀,所以加入碳酸钠溶液的作用是除去粗盐中的Ca2+和过量的Ba2+,
故答案为:除去粗盐中的Ca2+和过量的Ba2+.
点评 本题主要考查粗盐提纯的步骤及注意事项,题目难度不大,注意掌握除杂试剂的选择及加入试剂的先后顺序,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
16.物质 R2CO3 的饱和溶液 V mL,密度为 ρ g•cm-3,c(R+)=P mol•L-1,溶质的质量分数为 a%,溶质的式量为 M.则下列表达式正确的是( )
| A. | a=$\frac{PM}{2000ρ}$ | B. | P=$\frac{200ρa}{M}$ | C. | P$\frac{1000ρ×a%}{M}$×2 | D. | V×ρ×a%=$\frac{PMV}{1000}$ |
16.如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )


| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 | |
| D. | 长玻璃导管只有导气的作用 |
13.1000ml某待测溶液中除含有0.2mol•L-1的Na+外,还可能含有下列离子中的一种或多种:
现进行如下实验操作(每次实验所加试剂均过量):
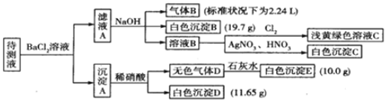
(1)写出生成白色沉淀B的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O.
(2)待测液中肯定不存在的阳离子是Fe3+、Ba2+.
(3)若无色气体D是单一气体:判断原溶液中K+是否存在存在(填是或否),若存在,求其物质的量浓度的最小值,若不存在,请说明理由:由电荷守恒可知K+离子最小浓度为0.1mol/L.
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是CO32-、HCO3-、SO32-.
②沉淀A中能与稀硝酸反应的成分是BaCO3、BaSO3(写化学式).
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |

(1)写出生成白色沉淀B的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O.
(2)待测液中肯定不存在的阳离子是Fe3+、Ba2+.
(3)若无色气体D是单一气体:判断原溶液中K+是否存在存在(填是或否),若存在,求其物质的量浓度的最小值,若不存在,请说明理由:由电荷守恒可知K+离子最小浓度为0.1mol/L.
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是CO32-、HCO3-、SO32-.
②沉淀A中能与稀硝酸反应的成分是BaCO3、BaSO3(写化学式).
10.A、B、C、D、E均是由下列离子组成的可溶性化合物.组成这五种物质的离子有(离子不能重复组合):
分别取它们进行实验,结果如下:
①A溶液与D溶液混合,没有明显现象;
②当B溶液加入到D溶液中时,有沉淀产生.继续加入B溶液,沉淀全部消失.
③将E溶液加热,有沉淀生成.
据此推断:AFe2(SO4)3;BBa(OH)2;CNa2CO3;DAlCl3;EMg(HCO3)2.
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ Fe3+ |
| 阴离子 | OH- Cl- CO32- SO42- HCO3- |
①A溶液与D溶液混合,没有明显现象;
②当B溶液加入到D溶液中时,有沉淀产生.继续加入B溶液,沉淀全部消失.
③将E溶液加热,有沉淀生成.
据此推断:AFe2(SO4)3;BBa(OH)2;CNa2CO3;DAlCl3;EMg(HCO3)2.
14.由短周期元素组成的中学常见物质A、B、C,D、E、X,存在如图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )A$\stackrel{E}{→}$B$\stackrel{B}{→}$C$\stackrel{X}{→}$D.
| A. | 若D与盐酸反应,可生成A和B,则X一定是H2O | |
| B. | 若D为NaCl,且A可与C反应生成B,则E 可能是CO2 | |
| C. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| D. | 若D是一种强酸,则A既可以是单质,也可以是化合物 |
15.下列实验操作完全正确的是( )
| 编号 | 实验 | 操作 |
| A | 用浓硫酸配制一定浓度的稀硫酸 | 准确量取浓硫酸,将浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中. |
| B | 除去BaSO4中的少量BaCO3 | 加入足量盐酸,充分反应后,过滤、洗涤、干燥 |
| C | 量取盐酸溶液 | 用25mL量筒量取4.0mol/L的盐酸5.62mL |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
| A. | A | B. | B | C. | C | D. | D |