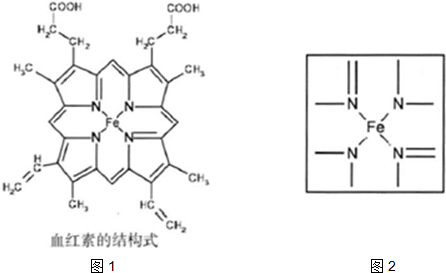
题目内容
(16分)(1)有Fe2+、NO-3、Fe3+、NH+4、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物。
①请写出该反应的离子方程式(不要求配平) 。
②该反应中氧化剂与还原剂的物质的量之比为 。
③产生2mol还原产物时转移电子的总数为 。
(2)实验室配制0.5mol/L的NaCl溶液500mL,有以下仪器;
①烧杯②100mL量筒③1000 mL容量瓶④500mL容量瓶⑤玻璃棒⑥托盘天平(带砝码)配制时,必须使用的仪器有 (填序号),还缺少的仪器是 实验两次用到玻璃棒,其作用分别是 、 。
mL容量瓶④500mL容量瓶⑤玻璃棒⑥托盘天平(带砝码)配制时,必须使用的仪器有 (填序号),还缺少的仪器是 实验两次用到玻璃棒,其作用分别是 、 。
(3)有一瓶澄清的溶液,可有含有大量的NO-3、Fe3+、NH+4、H+、K+、Mg2+、Al3+、SO2-4、Ba2+、CO2-3、Cl-、I-,现进行如下实验:
①测知溶液显酸性;
②取样加少量四氯化碳和数滴新制氯水,四氯化碳层溶液呈紫红色;
③另取样滴加稀NaOH溶液,使深液变为碱性,此过程中无沉淀生成;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
⑤ 将实验③中的碱性溶液加热,有气体放出,该气体
将实验③中的碱性溶液加热,有气体放出,该气体 能使湿润的红色石蕊试纸变蓝。
能使湿润的红色石蕊试纸变蓝。
由此可以推断:
溶液中肯定存在的离子有 。
溶液中不能确定是否存在的离子有 。
(共16分)(1)①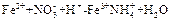 (2分) ②1︰8(2分)
(2分) ②1︰8(2分)
③16NA(或9.632×1024)(2分)
(2)①④⑤⑥(2分)药匙、胶头滴管(2分)胶头滴管(0 分)搅拌;引流(2分)
分)搅拌;引流(2分)
(3)H+、NH+4、I-、Ba2+(2分) K+、Cl-(2分)
解析

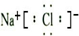
 HCN+OH-
HCN+OH-