题目内容
有M、N两种溶液,经测定共含有10种离子(不考虑水的电离):Na+、K+、Fe2+、
、Cl-、
、OH-、
、
、H+.现取少量的M、N溶液进行如下实验:
①取少量N溶液,滴加足量的Ba(NO3)2溶液,无明显现象;
②取M溶液进行焰色反应,焰色为黄色;透过蓝色钴玻璃观察,不呈紫色.
根据以上实验,回答下列问题:
(1)由实验①得出的结论为 .
(2)
存在于(填M或N) 溶液中,理由是 .
(3)Cl-存在于(填M或N) 溶液中,理由是 .
(4)M溶液中含有的离子为 .
| NH | + 4 |
| NO | - 3 |
| CO | 2- 3 |
| SO | 2- 4 |
①取少量N溶液,滴加足量的Ba(NO3)2溶液,无明显现象;
②取M溶液进行焰色反应,焰色为黄色;透过蓝色钴玻璃观察,不呈紫色.
根据以上实验,回答下列问题:
(1)由实验①得出的结论为
(2)
| NO | - 3 |
(3)Cl-存在于(填M或N)
(4)M溶液中含有的离子为
分析:①能够与钡离子反应生成沉淀的离子一定不在N溶液中;
②M溶液中含有钠离子,不含钾离子,
然后根据离子共存知识及溶液呈电中性判断出M、N溶液中含有的离子.
②M溶液中含有钠离子,不含钾离子,
然后根据离子共存知识及溶液呈电中性判断出M、N溶液中含有的离子.
解答:解:①取少量N溶液,滴加足量的Ba(NO3)2溶液,无明显现象,证明N溶液中不含CO32-、SO42-,M中含有CO32-、SO42-,
②取M溶液进行焰色反应,焰色为黄色;透过蓝色钴玻璃观察,不呈紫色,说明M溶液中含有Na+,N溶液中含有K+;
(1)CO32-、SO42-能够与钡离子反应生成沉淀,所以N溶液中不含CO32-、SO42-,M溶液中含有CO32-、SO42-,
故答案为:N溶液中不含CO32-、SO42-(或M溶液中含有CO32-、SO42-);
(2)由于N溶液中含有大量的H+、Fe2+,在大量的H+存在下Fe2+与NO3-发生氧化还原反应,所以硝酸根离子存在于M中,
故答案为:M;N溶液中含有大量的H+、Fe2+,在大量的H+存在下Fe2+与NO3-发生氧化还原反应;
(3)由于除Cl-外其他阴离子均存在于M溶液中,可以确定Cl-存在于N溶液中(或溶液呈电中性),
故答案为:N;除Cl-外其他阴离子均存在于M溶液中,可以确定Cl-存在于N溶液中(或溶液呈电中性)
(4)根据以上分析,M中存在的离子有:NO3-、CO32-、SO42-、Na+、OH-,N中存在的离子有:Cl-、H+、Fe2+、K+、NH4+,
故答案为:NO3-、CO32-、SO42-、Na+、OH-.
②取M溶液进行焰色反应,焰色为黄色;透过蓝色钴玻璃观察,不呈紫色,说明M溶液中含有Na+,N溶液中含有K+;
(1)CO32-、SO42-能够与钡离子反应生成沉淀,所以N溶液中不含CO32-、SO42-,M溶液中含有CO32-、SO42-,
故答案为:N溶液中不含CO32-、SO42-(或M溶液中含有CO32-、SO42-);
(2)由于N溶液中含有大量的H+、Fe2+,在大量的H+存在下Fe2+与NO3-发生氧化还原反应,所以硝酸根离子存在于M中,
故答案为:M;N溶液中含有大量的H+、Fe2+,在大量的H+存在下Fe2+与NO3-发生氧化还原反应;
(3)由于除Cl-外其他阴离子均存在于M溶液中,可以确定Cl-存在于N溶液中(或溶液呈电中性),
故答案为:N;除Cl-外其他阴离子均存在于M溶液中,可以确定Cl-存在于N溶液中(或溶液呈电中性)
(4)根据以上分析,M中存在的离子有:NO3-、CO32-、SO42-、Na+、OH-,N中存在的离子有:Cl-、H+、Fe2+、K+、NH4+,
故答案为:NO3-、CO32-、SO42-、Na+、OH-.
点评:本题考查了常见离子的检验方法,题目难度不大,注意学会根据溶液呈电中性判断离子的存在的方法,要求熟练掌握常见离子的检验方法,能够根据反应现象推断存在离子.

练习册系列答案
相关题目
有M、N两种溶液,经测定这两种溶液中含有下列12种离子:Al3+、Cl-、Na+、K+、NO3-、OH-、Fe2+、AlO2-、CO32-、NH4+、SO42-、H+。
(1)完成下列表格中实验①的结论和实验②的实验内容以及现象:
|
实验内容以及现象 |
结论 |
|
①取少量N溶液滴加足量的硝酸钡溶液,无沉淀产生 |
N中不含 离子 |
|
② |
确定M溶液中含有Na+,不含K+ |
|
|
|
(2)根据①、②、③中的实验回答:
NO3-存在于________溶液中,理由是____________________________________;
Cl-存在于________溶液中,是根据_________________ 确定的。
(3)根据(1)中的实验确定,M溶液中含有的离子为________________________。




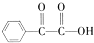


 )氧化生成,写出该反应的化学方程式:
)氧化生成,写出该反应的化学方程式:
 )经浓硫酸催化而生成,写出该反应的化学方程式:
)经浓硫酸催化而生成,写出该反应的化学方程式:


 ③用pH试纸检测M溶液,pH试纸呈蓝色
③用pH试纸检测M溶液,pH试纸呈蓝色