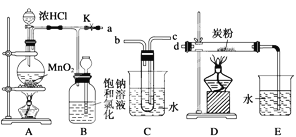
题目内容
【题目】(1)已知下列数据:
化学键 | H-H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图,试根据表中及图中数据计算N-H的键能______________。

(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
写出肼和N2O4反应的热化学方程式______________________________。
(3)若用标准状况下4.48LO2氧化N2H4至N2,整个过程中转移的电子总数为___________(阿伏加德罗常数用NA表示)。
【答案】390 kJ·mol-1 2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH=-1048.9 kJ·mol-1 0.8NA
【解析】
(1)先求出此反应的焓变,根据反应热等于反应物的总键能减去生成物的总键能计算;
(2)利用盖斯定律计算;
(3)利用得失电子守恒计算。
(1) 反应物总能量大于生成物总能量,应为放热反应,生成1mol氨气放出300kJ-254kJ=46kJ热量,则反应的热化学方程式为![]() △H=-92 kJ·mol-1 。反应热等于反应物的总键能减去生成物的总键能,设N-H的键能为x,则
△H=-92 kJ·mol-1 。反应热等于反应物的总键能减去生成物的总键能,设N-H的键能为x,则![]() ,解得x=390kJmol-1,故答案为:390 kJ·mol-1;
,解得x=390kJmol-1,故答案为:390 kJ·mol-1;
(2)据盖斯定律,②×2-①得肼和N2O4反应的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)ΔH=-1048.9 kJ·mol-1;
(3) 4.48LO2的物质的量为0.2mol,N2H4转化成N2,N元素的化合价由-2价上升到0价,氧元素由0价下降到-2价,故0.2mol O2转移0.2mol×4=0.8mol电子,个数为0.8NA。

【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为____________反应(填“吸热”、“放热”)。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是___________。
a.及时分离出CO气体 b.适当升高温度
c.增大CO2的浓度 d.选择高效催化剂
(3)某温度,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______℃。
(4)若在(3)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为__________,CO2的物质的量为__________。
a.等于1.0mol b.大于1.0mol c.大于0.5mol,小于1.0mol d.无法确定
(5)根据研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) ΔH=akJ·mol-1
4NH3(g)+3O2(g) ΔH=akJ·mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的
②已知:N2(g)+3H2(g)=2NH3(g) ΔH=-92.4kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:_____________________________。