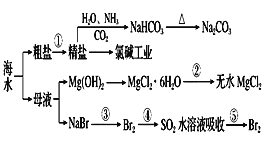
题目内容
【题目】(1)室温下,以惰性电极电解100 mL 0.1mol/LNaCl溶液,写出电解总反应的化学方程式______________________________________;若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为_________(忽略反应前后溶液的体积变化)。
(2)某学生用中和滴定法测定某NaOH溶液的物质的量浓度,选酚酞作指示剂。盛装0.2000 mol/L盐酸标准液应该用________式滴定管;用盐酸滴定待测液NaOH,滴定终点时的颜色变化是____________________且30s不变色;滴定前用待测液润洗锥形瓶,则所测NaOH溶液的浓度___________(填“无影响”、“偏高”或“偏低”下同);若滴定前平视读数,滴定终点时俯视读数,则会使所测NaOH溶液的浓度值___________。
【答案】略 酸 浅红色变为无色 偏高 偏低 略
【解析】
本题考查的知识点是电解池和酸碱中和滴定。
(1)电解氯化钠溶液生成氯气、氢气和氢氧化钠,由电解方程式可计算出氢氧根的浓度,进而算出pH;
(2)盐酸为酸溶液,应该用酸式滴定管;根据滴定前为红色,滴定结束时为无色判断滴定终点时的现象;滴定前用待测液润洗锥形瓶,导致待测液的物质的量增大,测定结果偏高;滴定终点时俯视读数,导致读出的标准液体积偏小,测定结果偏低。
(1)电解饱和食盐水在阴极得到氢气,阳极得到氯气,反应方程式为:2NaCl+2H2O
![]() Cl2↑+H2↑+2NaOH;若阴阳两极均得到112 mL气体(标准状况),则生成氢气和氯气的物质的量均为:
Cl2↑+H2↑+2NaOH;若阴阳两极均得到112 mL气体(标准状况),则生成氢气和氯气的物质的量均为:![]() ,由2NaCl+2H2O
,由2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH可知:Cl2↑~H2↑~2NaOH,则n(NaOH)=2n(Cl2)=2n(H2)=2×0.005mol=0.01mol,氢氧化钠溶液的浓度为:c(NaOH)═0.1mol/L,所以溶液的pH=13。本小题答案为:2NaCl+2H2O
Cl2↑+H2↑+2NaOH可知:Cl2↑~H2↑~2NaOH,则n(NaOH)=2n(Cl2)=2n(H2)=2×0.005mol=0.01mol,氢氧化钠溶液的浓度为:c(NaOH)═0.1mol/L,所以溶液的pH=13。本小题答案为:2NaCl+2H2O
![]() Cl2↑+H2↑+2NaOH;13。
Cl2↑+H2↑+2NaOH;13。
(2)盐酸为强酸,盛装0.2000mol/L盐酸标准液应该用酸式滴定管;用盐酸滴定待测液NaOH,接近滴定终点时溶液为浅红色,滴定终点时为无色,则滴定终点时溶液的颜色变化是:浅红色变为无色且30s不变色;滴定前用待测液润洗锥形瓶,导致待测液的物质的量偏大,耗酸量偏大,则所测NaOH溶液的浓度偏高;若滴定前平视读数,滴定终点时俯视读数,导致滴定终点的读数偏小,则读出的标准液体积偏小,会使所测NaOH溶液的浓度值偏低,本小题答案为:酸;浅红色变为无色;偏高;偏低。

【题目】下表是元素周期表中短周期元素的一部分,表中所列序号分别代表一种元素。(除说明外都用化学用语填空)
① | ② | ||||||||||||||||
③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||||||||||||
⑨ | ⑩ | ||||||||||||||||
⑴上述元素中金属性最强和非金属性最强的元素名称分别是_____________;
(2) ⑥和⑦的气态氢化物稳定性比较(写化学式):_____________________;
(3)在上述元素中其最高价氧化物对应水化物酸性最强的酸为_________;其与④的最高价氧化物对应水化物反应的化学方程式为______________________________ 。
(4)现有上表中某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,该元素在周期表中的位置是______________________________;
(5)比较⑦和⑨对应简单离子的离子半径大小(用相应离子符号表示)______________________________。
(6)写出⑨的最高价氧化物对应水化物的电子式____________________;其含有的化学键类型是_____________________________。