题目内容
已知常温下在溶液中可发生如下两个离子反应:
Ge4++Fe2+=Fe3++Ge3+①;Sn2++2Fe3+=2Fe2++Sn4+②
由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是
| A.Sn2+、Fe2+、Ge3+ | B.Sn2+、Ge3+、Fe2+ |
| C.Ge3+、Fe2+、Sn2+ | D.Fe2+、Sn2+、Ge3+ |
A
解析试题分析:在氧化还原反应中还原剂的还原性强于还原产物的还原性,据此可以判断。根据反应Ge4++Fe2+=Fe3++Ge3+可知,还原剂是Fe2+、还原产物是Ge3+,所以还原性是Fe2+>Ge3+;根据反应Sn2++2Fe3+=2Fe2++Sn4+可知,还原剂是Sn2+、还原产物是Fe2+,所以还原性是Sn2+>Fe2+,因此还原性强弱顺序是Sn2+>Fe2+>Ge3+,答案选A。
考点:考查还原性强弱比较的有关判断

 计算高手系列答案
计算高手系列答案氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧;跟盐酸反应能产生气体,以下有关的推断中错误的是
| A.“另一种反应物”一定具有还原性 |
| B.CuH既可做氧化剂也可做还原剂 |
| C.CuH+Cl2=CuCl+HCl(燃烧) |
| D.CuH+HCl=CuCl+H2↑(常温) |
硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是( )
| A.1:3 | B.2:3 | C.1:1 | D.4:3 |
在加热时,浓硫酸与铜发生反应的化学方程式为:
2H2SO4(浓)+Cu  CuSO4+SO2↑+2H2O,对于该反应,下列说法中不正确的是
CuSO4+SO2↑+2H2O,对于该反应,下列说法中不正确的是
| A.是氧化还原反应 | B.铜是还原剂 |
| C.H2SO4表现了氧化性和酸性 | D.反应后铜元素的化合价降低 |
过氧化氢(O为—1价)在二氧化锰催化作用下分解放出氧气的反应机理如下:
①MnO2 + H2O2 + 2H+ = Mn2+ + O2↑ + 2H2O ②Mn2+ + H2O2 = MnO2 + 2H+
下列说法正确的是( )
| A.H2O2在①中是氧化剂,在②中是还原剂 |
| B.在①中每生成1 mol O2,转移的电子数为1.204×1024 |
| C.Mn2+在①中是还原产物,在②中是氧化产物 |
| D.在二氧化锰催化作用下,1 mol H2O2分解生成22.4 L O2 |
某溶液中阳离子只含K+,其中Cl-、Br-、I-的个数比为1∶2∶3,欲使这些离子个数比变为3∶2∶1,需要通入的氯分子与原溶液中I-的个数比应为( )
| A.1∶2 | B.2∶1 | C.1∶3 | D.3∶1 |
下列化学反应既不属于氧化还原反应又不属于四种基本反应类型的是( )
| A.Cl2+2KBr=Br2+2KCl |
B.2NaHCO3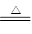 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
C.3O2 2O3 2O3 |
D.CH4+2O2 CO2+2H2O CO2+2H2O |
下列反应中,属于氧化还原反应的是
| A.CaCO3+2HCl=CaCl2+CO2↑+H2O |
| B.CaO+H2O=Ca(OH)2 |
C.2H2O2 2H2O+O2↑ 2H2O+O2↑ |
D.CaCO3 CaO+2CO2↑ CaO+2CO2↑ |
制取新型水处理剂ClO2的化学方程式为:
2KClO3+H2C2O4+H2SO4 2ClO2+K2SO4+2CO2+2H2O。下列说法不正确的是
2ClO2+K2SO4+2CO2+2H2O。下列说法不正确的是
| A.KClO3在反应中得到电子 | B.ClO2是还原产物 |
| C.H2C2O4 在反应中被氧化 | D.1mol KClO3参加反应有2mol电子转移 |