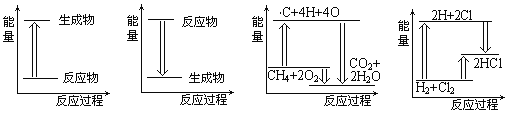
��Ŀ����
����Ŀ����ͼA��B��C�����ձ��зֱ�ʢ����ͬ���ʵ���Ũ�ȵ�ϡ���ᡣ
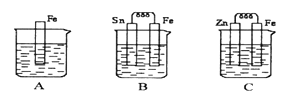
��1��A�з�Ӧ�����ӷ���ʽΪ____________��B��Sn����������ֵ�����_________________��C��ZnƬ�ϵĵĵ缫��ӦʽΪ________������__________��Ӧ���������Ӧ����ԭ��Ӧ������
��2��A��B��C�����ܽ�������ɿ쵽����˳����_________________ ��
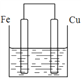
��3������������ȵ���Ƭ��ͭƬ�õ���������������ͭ��Һ�й���ԭ��أ���ͼ��������_________����������Ԫ�ط��ţ���һ��ʱ������缫�������1.2g��������ͨ���ĵ��ӵ����ʵ���Ϊ______mol��
���𰸡� Fe��2H �� =Fe 2�� ��H 2 �� �����ݲ��� Zn - 2e ��= Zn 2�� ������Ӧ B ��A��C Fe 0.02mol
��������(1)�������ᷴӦ�����ӷ���ʽΪ��Fe+2H+=Fe2++H2����B�����������ã���Ϊԭ����������缫��ӦʽΪ��2H++2e-=H2���������ݲ�����C��п�������ã�пΪԭ��ظ���������������Ӧ�������缫��ӦʽΪZn-2e-=Zn2+���ʴ�Ϊ��Fe+2H+=Fe2++H2���������ݲ�����Zn-2e-=Zn2+��������Ӧ��
(2)A������ѧ��ʴ��B��FeΪ������SnΪ������Fe����ʴ��C��ZnΪ������FeΪ������Fe����������A��B��C��������ʴ�����ʣ��ɿ쵽����˳����B��A��C���ʴ�Ϊ��B��A��C��
(3)����ͭ���ã���Ϊԭ��صĸ��������ӴӸ�����������ת��xmol���ӣ�������0.5xmolFe������0.5xmolCu������0.5x��(64+56)=1.2��x=0.02���ʴ�Ϊ��Fe��0.02mol��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�