题目内容
某试液中只可能含有K+、NH4+、Fe2+、Al3+、C lˉ、CO
lˉ、CO 、SO
、SO 、NO3-中的若干种离子,离子浓度均为0.1 mol·Lˉ1,某同学进行如下实验:下列说法正确的是( )
、NO3-中的若干种离子,离子浓度均为0.1 mol·Lˉ1,某同学进行如下实验:下列说法正确的是( )
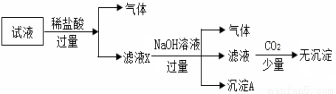
A.原试液中可能含有CO 、K+、NH4+
、K+、NH4+
B.无法确定沉淀A的成分
C.无法确定原试液中 有Al3+、K +、Clˉ
有Al3+、K +、Clˉ
D.原溶液中一定存在的离子为NH 、Fe2+、SO
、Fe2+、SO 、NO3-
、NO3-
甲醇是21世纪应用最广泛的清洁燃料之一,通过以下反应可以制备甲醇:
CO(g)+2H2(g)=CH3OH(l) △H=?
(1)已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
2CO(g)+O2(g)=2C O2(g) △H=-566.0kJ·mol-1
O2(g) △H=-566.0kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453.0kJ·mol-1
则制备甲醇反应的△H = kJ·mol-1
(2)若装置为容积固定的密闭容器,不同时间段各物质的浓度如下表:
c(CO) /mol·L-1 | c(H2) /mol·L-1 | c(CH3OH) /mol·L-1 | |
0min | 0.8 | 1.6 | 0 |
2min | 0.6 | y | 0.2 |
4min | 0.3 | 0.6 | 0.5 |
6min | 0.3 | 0.6 | 0.5 |
反应从2min到4min之间,H2的平均反应速率为________ mol·Lˉ1·minˉ1。
反应在第2min时改变了反应条件,改变的条件可能是 (填字母序号)。
A.使用催化剂 B.降低温度 C.增加H2的浓度 D.减小CH3OH(g)的浓度
(3)若在容积可变的密闭容器中充入1 mol CO(g)和2 molH2 (g)生成CH3OH(g),H2的平衡转化率随温度(T)、压强(P)的变化如图所示。当达到平衡状态A 时,容器的体积为2 L,此时该反应的平衡常数为 ,若达到平衡状态B 时,则容器的体积V(B)= L。

(4)一定温度下,在容积固定的密闭容器中充入一定量的H2和CO,在t1时达到平衡。t2时将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时达到新的平衡状态,之后不再改变条件。请在右图中补画出从t2到t4正反应速率随时间的变化曲线。

已 知:4HCl(g)+O2 (g)
知:4HCl(g)+O2 (g)  2C12 (g)+2H2O(g) △H =-123 kJ·mol-1。其中相关的化学键键能数据如下:
2C12 (g)+2H2O(g) △H =-123 kJ·mol-1。其中相关的化学键键能数据如下:
化学键 | H-Cl | O=O | Cl-Cl | H-O |
E/ kJ·mol-1 | 431 | 497 | a | 465 |
其中a值为( )
A.242 B.303.5 C.180.5 D.365


 Si(s)+4HCl(g); △H = + QkJ/mol (Q>0),一定温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是 ( )
Si(s)+4HCl(g); △H = + QkJ/mol (Q>0),一定温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是 ( ) min)
min) 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( ) CO2+H2
CO2+H2 D.反应热均可通过实验直接测定
D.反应热均可通过实验直接测定 O2(g)=Na2O(s) ΔH1=-414 kJ·mol-1
O2(g)=Na2O(s) ΔH1=-414 kJ·mol-1 CO2(g)+H2(g),达到平衡时。
CO2(g)+H2(g),达到平衡时。