题目内容
高温下,超氧化钾晶体(KO2)呈立方体结构。如图为
超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。
则有关下列说法正确的是:
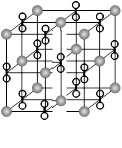
超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。
则有关下列说法正确的是:

| A.KO2中只存在离子键 |
| B.超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2- |
| C.晶体中与每个K+距离最近的O2-有6个 |
| D.晶体中,所有原子之间都是以离子键结合 |
C
A.O-O间为共价键;
B.晶胞结构和NaCl晶体一样,用均摊法来分析,顶点占1/8,面心占1/2,棱上中心占1/4,体心占1;超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-;
C.晶体中与每个K+距离最近的O2-有12个。同层四个,上层四个,下层四个。
D.晶体中O-O间为共价键。
B.晶胞结构和NaCl晶体一样,用均摊法来分析,顶点占1/8,面心占1/2,棱上中心占1/4,体心占1;超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-;
C.晶体中与每个K+距离最近的O2-有12个。同层四个,上层四个,下层四个。
D.晶体中O-O间为共价键。

练习册系列答案
相关题目
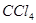 C.
C. 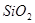 D.
D. 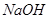
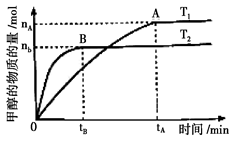
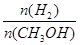 ④处于A点的反应体系从T1变到T2,
④处于A点的反应体系从T1变到T2, CO(g)+3H2(g)……Ⅰ
CO(g)+3H2(g)……Ⅰ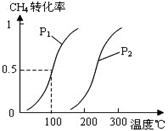
 CH3OH(g)……Ⅱ
CH3OH(g)……Ⅱ