题目内容
在200mL氯化镁和氯化铝的混合液中,Mg2+的物质的量浓度为0.2mol/L,Cl-的物质的量浓度为1.3 mol/L。要使Mg2+全部转化为沉淀分离出来,至少需要加入4 mol/L NaOH溶液的体积为
| A.80mL | B.128mL | C.40mL | D.72mL |
A
试题分析:在200mL氯化镁和氯化铝的混合液中,Mg2+的物质的量浓度为0.2mol/L,Cl-的物质的量浓度为1.3 mol/L。根据电荷守恒,2C(Mg2+)+3C(Al3+)=C(Cl-),代入数据,计算C(Al3+)=0.3mol/L,可知n(Mg2+)="0.04mol" ,n(Al3+)="0.06mol" ,根据Mg2++2OH-=Mg(OH)2,Al3++4OH-=AlO2-+2H2O,可知n(OH-)=0.08+0.24=0.32mol,所以需要NaOH溶液的体积为80ml。A正确。

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
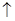
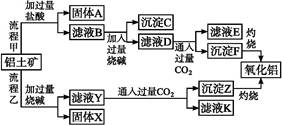
 Na2Al2Si2O8↓+4NaOH,请回答下列问题:
Na2Al2Si2O8↓+4NaOH,请回答下列问题: