题目内容
(2011?南京一模)下列叙述正确的是( )
分析:A、根据l一溴丙烷和2一溴丙烷的中有几种不同的H原子分析;
B、增大反应物的浓度不能改变活化分子的百分数;
C、AlCl3溶液加热时水解,灼烧后生成Al2O3,NaAl02溶液分别蒸干后灼烧,所得固体产物仍为NaAl02;
D、物质的量浓度的硫酸钠和硫酸铝溶液中硫酸根离子的浓度不同;
B、增大反应物的浓度不能改变活化分子的百分数;
C、AlCl3溶液加热时水解,灼烧后生成Al2O3,NaAl02溶液分别蒸干后灼烧,所得固体产物仍为NaAl02;
D、物质的量浓度的硫酸钠和硫酸铝溶液中硫酸根离子的浓度不同;
解答:解:A、l一溴丙烷的结构简式为CH2BrCH2CH3,含有3种不同的H原子,2一溴丙烷的结构简式为CH3CHBrCH3,还有2种不同的H原子,用核磁共振氢谱可以鉴别l一溴丙烷和2一溴丙烷,故A正确;
B、增大反应物的浓度则增大了活化分子的数目,所以反应速率增大,故B错误;
C、AlCl3溶液加热时水解,灼烧后生成Al2O3,NaAl02溶液分别蒸干后灼烧,所得固体产物仍为NaAl02,故C错误;
D、BaS04难溶,在水中存在平衡:BaS04(s) Ba2+(aq)+SO42-(aq),相同物质的量浓度的硫酸钠和硫酸铝溶液中硫酸根离子的浓度不同,后者硫酸根离子浓度大,故BaS04在硫酸铝溶液中的溶解度小,故D错误.
Ba2+(aq)+SO42-(aq),相同物质的量浓度的硫酸钠和硫酸铝溶液中硫酸根离子的浓度不同,后者硫酸根离子浓度大,故BaS04在硫酸铝溶液中的溶解度小,故D错误.
故选A.
B、增大反应物的浓度则增大了活化分子的数目,所以反应速率增大,故B错误;
C、AlCl3溶液加热时水解,灼烧后生成Al2O3,NaAl02溶液分别蒸干后灼烧,所得固体产物仍为NaAl02,故C错误;
D、BaS04难溶,在水中存在平衡:BaS04(s)
 Ba2+(aq)+SO42-(aq),相同物质的量浓度的硫酸钠和硫酸铝溶液中硫酸根离子的浓度不同,后者硫酸根离子浓度大,故BaS04在硫酸铝溶液中的溶解度小,故D错误.
Ba2+(aq)+SO42-(aq),相同物质的量浓度的硫酸钠和硫酸铝溶液中硫酸根离子的浓度不同,后者硫酸根离子浓度大,故BaS04在硫酸铝溶液中的溶解度小,故D错误.故选A.
点评:本题考查较为综合,涉及物质的检验、化学平衡、盐类的水解以及难溶电解质的溶解平衡等问题,题目难度中等,注意溶解度和溶度积常数的不同.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
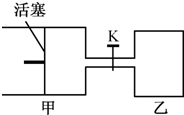 (2011?南京一模)如图所示,向甲和乙两容器中都充入2molX和2molY(K关闭) 起始V甲=0.8aL,V乙=aL,在相同恒定温度下,两容器中各自发生下列反应:X(g)+Y(g)═2Z(g)+W(g),达到平衡时,V甲=0.9aL,则下列说法错误的是( )
(2011?南京一模)如图所示,向甲和乙两容器中都充入2molX和2molY(K关闭) 起始V甲=0.8aL,V乙=aL,在相同恒定温度下,两容器中各自发生下列反应:X(g)+Y(g)═2Z(g)+W(g),达到平衡时,V甲=0.9aL,则下列说法错误的是( ) 是一种可限量使用的铁强化剂
是一种可限量使用的铁强化剂