题目内容
下列叙述正确的是
| A.相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
| B.2 L 0.05 mol·L-1乙酸溶液中H+数为0.1NA(NA为阿伏加德罗常数) |
| C.SO2溶于水,其水溶液能导电,说明SO2是电解质 |
| D.常温下在pH=1的溶液中Na+、NH4+、[Al(OH)4]-、SO42-可以大量共存 |
A
试题分析:A、气态硫的能量高于固态硫的能量,所以在相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多,A正确;
B、乙酸是弱酸,存在电离平衡,所以2 L 0.05 mol·L-1乙酸溶液中H+数小于0.1NA(NA为阿伏加德罗常数),B不正确;
C、溶于水或在熔融状态下能够自身电离出阴阳离子的化合物是电解质,溶于水和在熔融状态下不能够自身电离出阴阳离子的化合物是非电解质。SO2溶于水,其水溶液能导电,是因为SO2与水反应生成的亚硫酸电离出离子,亚硫酸是电解质,SO2是非电解质,C不正确;
D、常温下在pH=1的溶液中,溶液显酸性, [Al(OH)4]-不能大量共存,D不正确,答案选A。

练习册系列答案
相关题目
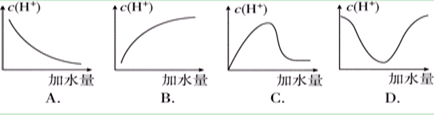
 RNH3++OH-的平衡中,要使RNH2·H2O的电离程度及c(OH-)都增大,可采取的措施是
RNH3++OH-的平衡中,要使RNH2·H2O的电离程度及c(OH-)都增大,可采取的措施是
 H3O+ + CO32—
H3O+ + CO32— 增大
增大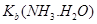 不变
不变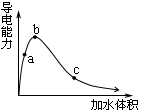
 CH3OH(g),现在实验室模拟该反应并进行分析。
CH3OH(g),现在实验室模拟该反应并进行分析。