题目内容
某温度下,H2 (g) + CO2 (g)  H2O(g) + CO(g) (ΔH>0)的平衡常数
H2O(g) + CO(g) (ΔH>0)的平衡常数 ,该温度下在甲、乙、丙、丁四个恒容的密闭容器中投入原料的起始浓度如下表:
,该温度下在甲、乙、丙、丁四个恒容的密闭容器中投入原料的起始浓度如下表:
下列判断有错的是
A.平衡时,乙中CO2的转化率>60%
B.平衡时,四容器中甲的 值最小
值最小
C.起始时丁向正反应方向进行
D.反应开始时,丙中反应速率最快
 H2O(g) + CO(g) (ΔH>0)的平衡常数
H2O(g) + CO(g) (ΔH>0)的平衡常数 ,该温度下在甲、乙、丙、丁四个恒容的密闭容器中投入原料的起始浓度如下表:
,该温度下在甲、乙、丙、丁四个恒容的密闭容器中投入原料的起始浓度如下表:| 起始浓度(mol/L) | 甲 | 乙 | 丙 | 丁 |
| c(H2) | 0.01 | 0.02 | 0.02 | 0.005 |
| c(CO2) | 0.01 | 0.01 | 0.02 | 0.005 |
| c(H2O) | 0 | 0 | 0 | 0.005 |
| c(CO) | 0 | 0 | 0 | 0.005 |
A.平衡时,乙中CO2的转化率>60%
B.平衡时,四容器中甲的
 值最小
值最小C.起始时丁向正反应方向进行
D.反应开始时,丙中反应速率最快
B
根据平衡常数可知,甲中平衡时生成CO和水的物质的量浓度都是x,则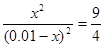 ,解得x=0.006,所以甲中CO2的转化率是60%,乙可以看作是在甲的基础上增加氢气的浓度,所以提高CO2的转化率,A正确。平衡常数只与温度有关系,所以四个容器中平衡常数是相同的,B不正确。选项C中
,解得x=0.006,所以甲中CO2的转化率是60%,乙可以看作是在甲的基础上增加氢气的浓度,所以提高CO2的转化率,A正确。平衡常数只与温度有关系,所以四个容器中平衡常数是相同的,B不正确。选项C中 =
=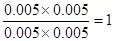 <
<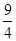 ,所以反应向正反应方向进行,C正确。丙中反应物的浓度增大,反应速率最快,D正确。答案选B。
,所以反应向正反应方向进行,C正确。丙中反应物的浓度增大,反应速率最快,D正确。答案选B。
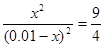 ,解得x=0.006,所以甲中CO2的转化率是60%,乙可以看作是在甲的基础上增加氢气的浓度,所以提高CO2的转化率,A正确。平衡常数只与温度有关系,所以四个容器中平衡常数是相同的,B不正确。选项C中
,解得x=0.006,所以甲中CO2的转化率是60%,乙可以看作是在甲的基础上增加氢气的浓度,所以提高CO2的转化率,A正确。平衡常数只与温度有关系,所以四个容器中平衡常数是相同的,B不正确。选项C中 =
=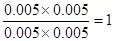 <
<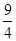 ,所以反应向正反应方向进行,C正确。丙中反应物的浓度增大,反应速率最快,D正确。答案选B。
,所以反应向正反应方向进行,C正确。丙中反应物的浓度增大,反应速率最快,D正确。答案选B。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( )
2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能出现的数据是( ) 2C(气)+2D(固)达到平衡的标志的是( )
2C(气)+2D(固)达到平衡的标志的是( )

 2Z,其平衡常数为1600
2Z,其平衡常数为1600 Q(g)达到平衡时,下列说法正确的是( )
Q(g)达到平衡时,下列说法正确的是( ) CO + H2O,
CO + H2O, 2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
 和
和 各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定
各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定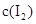 的变化,5S时测定
的变化,5S时测定 2HI(g)
2HI(g)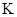 = ;
= ;