题目内容
(14分)FeCl3在选修四中出现的次数较多,可见其重要性.
(1)在演示催化剂对化学反应速率的影响实验中,向H2O2溶液中分别滴入FeCl3溶液和CuSO4溶液,催化效果更好的是________ (1分),画出无催化剂和有催化剂的能量-反应进程对比图,并作必要的文字注明(3分)
(2)在演示增加反应物浓度对化学平衡的影响实验中,稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。将该浅血红色分成两等份,分别加入同浓度的FeCl3溶液和稀KSCN溶液,红色变得更深的是________(1分), 从化学平衡常数的角度加以分析(3分)(温度不变,假设后加入的FeCl3溶液和稀KSCN溶液都是各自起始浓度的10倍)(3分)
(3)分别取若干毫升稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。限用FeCl3、KSCN、 KCl三种化学药品,为证明FeCl3溶液与KSCN溶液的反应是一个可逆反应,至少还要进行( )次实验。
(4)实验室配制和保存FeCl3溶液,要向其中加入________,防止其水解变质。
(5)0.1mol·L-1 FeCl3溶液中的c(Fe3+) 比0.1mol·L-1 (NH4)Fe(SO4)2溶液中的c(Fe3+)______.
(1)在演示催化剂对化学反应速率的影响实验中,向H2O2溶液中分别滴入FeCl3溶液和CuSO4溶液,催化效果更好的是________ (1分),画出无催化剂和有催化剂的能量-反应进程对比图,并作必要的文字注明(3分)
(2)在演示增加反应物浓度对化学平衡的影响实验中,稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。将该浅血红色分成两等份,分别加入同浓度的FeCl3溶液和稀KSCN溶液,红色变得更深的是________(1分), 从化学平衡常数的角度加以分析(3分)(温度不变,假设后加入的FeCl3溶液和稀KSCN溶液都是各自起始浓度的10倍)(3分)
(3)分别取若干毫升稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。限用FeCl3、KSCN、 KCl三种化学药品,为证明FeCl3溶液与KSCN溶液的反应是一个可逆反应,至少还要进行( )次实验。
| A.1 | B.2 | C.3 | D.4 |
(5)0.1mol·L-1 FeCl3溶液中的c(Fe3+) 比0.1mol·L-1 (NH4)Fe(SO4)2溶液中的c(Fe3+)______.
(1)FeCl3溶液(1分);
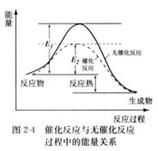 (两条线各1分,文字注明1分,共3分)
(两条线各1分,文字注明1分,共3分)
(2)KSCN溶液(1分);分析略(平衡常数表达式1分,指出平衡常数不变1分,数字分析1分,共3分)
(3)B (2分) (4)盐酸 (2分) (5)小 (2分)
 (两条线各1分,文字注明1分,共3分)
(两条线各1分,文字注明1分,共3分)(2)KSCN溶液(1分);分析略(平衡常数表达式1分,指出平衡常数不变1分,数字分析1分,共3分)
(3)B (2分) (4)盐酸 (2分) (5)小 (2分)
(1)根据实验选项可判断,氯化铁溶液的催化效果更好。催化剂能降低反应的活化能,但不能改变反应热,所以图像为
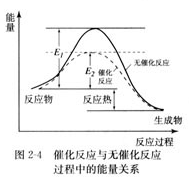 。
。
(2)根据反应的平衡常数表达式可知 ,KSCN溶液的浓度对平衡的影响更大,所以红色变得更深的是使KSCN溶液。
,KSCN溶液的浓度对平衡的影响更大,所以红色变得更深的是使KSCN溶液。
(3)要证明FeCl3溶液与KSCN溶液的反应是一个可逆反应,则可以通过增大FeCl3或KSCN浓度进行对照实验,比较溶液颜色变化从而证明改变反应物浓度能影响以及如何影响化学平衡,因此至少需要2次实验。
(4)氯化铁水解显酸性,所以为了防止水解需要加入盐酸。
(5)NH4+水解显酸性,所以可以抑制铁离子的水解,因此铁离子的浓度较大。
 。
。(2)根据反应的平衡常数表达式可知
 ,KSCN溶液的浓度对平衡的影响更大,所以红色变得更深的是使KSCN溶液。
,KSCN溶液的浓度对平衡的影响更大,所以红色变得更深的是使KSCN溶液。(3)要证明FeCl3溶液与KSCN溶液的反应是一个可逆反应,则可以通过增大FeCl3或KSCN浓度进行对照实验,比较溶液颜色变化从而证明改变反应物浓度能影响以及如何影响化学平衡,因此至少需要2次实验。
(4)氯化铁水解显酸性,所以为了防止水解需要加入盐酸。
(5)NH4+水解显酸性,所以可以抑制铁离子的水解,因此铁离子的浓度较大。

练习册系列答案
相关题目
 H2O(g) + CO(g) (ΔH>0)的平衡常数
H2O(g) + CO(g) (ΔH>0)的平衡常数 ,该温度下在甲、乙、丙、丁四个恒容的密闭容器中投入原料的起始浓度如下表:
,该温度下在甲、乙、丙、丁四个恒容的密闭容器中投入原料的起始浓度如下表: 值最小
值最小 2C(g);△H<0。若起始温度相同,分别向三个容器中通入3molA和1mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为
2C(g);△H<0。若起始温度相同,分别向三个容器中通入3molA和1mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为
 HSO3-+OH-水解平衡的事实是 _(填序号)。
HSO3-+OH-水解平衡的事实是 _(填序号)。
 2Q(g)+nR(g), 2min内达平衡,此时容器内温度不变,混合气体的压强比原来增加了5%,X的浓度减小了1/3。
2Q(g)+nR(g), 2min内达平衡,此时容器内温度不变,混合气体的压强比原来增加了5%,X的浓度减小了1/3。 2SO3(g),
2SO3(g), 下列叙述能够说明反应已经达到平衡状态的是( )
下列叙述能够说明反应已经达到平衡状态的是( )
 pC(g)+qD(g),根据图回答:
pC(g)+qD(g),根据图回答: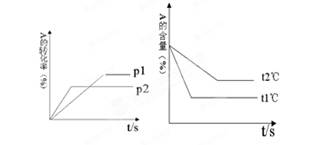
 xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空:
xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空: 2C(g),一段时间后达到平衡,生成a molC。则下列说法中正确的是( )
2C(g),一段时间后达到平衡,生成a molC。则下列说法中正确的是( )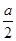 )
)