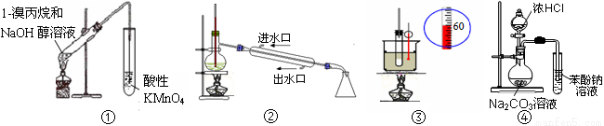
题目内容
温度为T℃,压强为1.01×106 Pa条件下,某密闭容器中发生反应:A(g)+aB(?)  4C(g),达到化学平衡时测得c(A)=0.2 mol·L-1;压缩容器使压强增大到2.02×106 Pa,第二次达到平衡时,测得c(A)=0.36 mol·L-1;若继续压缩容器,使压强增大到5.05×106 Pa,第三次达到平衡时,测得c(A)=1.1 mol·L-1。则下列有关说法不正确的是 ( )
4C(g),达到化学平衡时测得c(A)=0.2 mol·L-1;压缩容器使压强增大到2.02×106 Pa,第二次达到平衡时,测得c(A)=0.36 mol·L-1;若继续压缩容器,使压强增大到5.05×106 Pa,第三次达到平衡时,测得c(A)=1.1 mol·L-1。则下列有关说法不正确的是 ( )
A.第二次平衡时B为气态
B. a>3
C.第一次平衡后增大压强平衡向左移动
D.第三次达到平衡时B为非气态
C
【解析】第一次平衡后,压强增大一倍,气体体积减半,若平衡不移动,则c(A)应为0.4 mol·L-1,而实际上c(A)=0.36 mol·L-1,说明平衡向右移动,即正反应是气体体积减小的反应,故a>3,且B为气态,A、B项均正确、C项错误;第二次平衡后,压强增大到第二次平衡的2.5倍,若平衡不移动,则c(A)应为0.36 mol·L-1的2.5倍,即为0.9 mol·L-1,而实际上c(A)=1.1 mol·L-1,说明平衡向左移动,即逆反应是气体体积减小的反应,故B为非气态,D项正确。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案下表是不同温度下水的离子积常数:
温度/℃ | 25 | T1 | T2 |
水的离子积常数 | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<T1<T2,则a__________1×10-14 (填“>”、“<”或“=”),做此判断的理由是______________________________________。
(2)25℃时,某Na2SO4溶液中c(SO42—)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=__________。
(3)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__________。此溶液中各种离子的浓度由大到小的顺序是____________________________。
(4)常温下,设某pH值的硫酸中水电离出的c(H+)=1.0×10-a mol/L,设相同pH值的硫酸铝中水电离出的c(H+)=1.0×10-b mol/L,(a、b都是小于14的正数),那么a、b之间满足的关系式是________________。