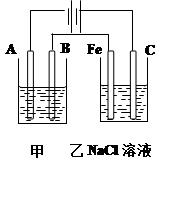
题目内容
工业上由二氧化锰制备高锰酸钾可分二步进行,第一步二氧化锰与氢氧化钾共熔并通入氧气2MnO2 + 4KOH +O2  2K2MnO4 +2H2O;第二步:电解锰酸钾溶液:
2K2MnO4 +2H2O;第二步:电解锰酸钾溶液:
2K2MnO4 +H2O 2KMnO4 +H2↑ +2 KOH 下列说法叙述正确的是
2KMnO4 +H2↑ +2 KOH 下列说法叙述正确的是
 2K2MnO4 +2H2O;第二步:电解锰酸钾溶液:
2K2MnO4 +2H2O;第二步:电解锰酸钾溶液:2K2MnO4 +H2O
 2KMnO4 +H2↑ +2 KOH 下列说法叙述正确的是
2KMnO4 +H2↑ +2 KOH 下列说法叙述正确的是 | A.氧化性:KMnO4>K2MnO4 >O2 |
| B.根据上述过程,每生成1molKMnO4共转移6mol电子 |
| C.第二步电解时阴极周围pH减小 |
| D.第二步电解时,KMnO4在阳极区生成 |
D
试题分析:A项:应为氧化性:KMnO4>O2>K2MnO4,故错;B项:生成1molKMnO4共转移3mol电子,故错;C项:有碱生成,PH增大,故错。故选D。
点评:本题考查的是氧化还原反应和电解原理的应用的相关知识,题目难度中等,注意基础知识的学习。

练习册系列答案
相关题目
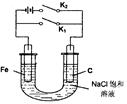
 4LiCl +S+SO2,则下列叙述中不正确的是
4LiCl +S+SO2,则下列叙述中不正确的是 M+D+E;②E+M=A+F+B
M+D+E;②E+M=A+F+B