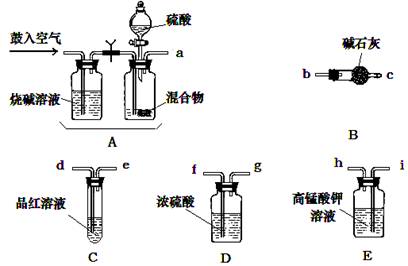
题目内容
实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。化学小组主要选用了下列药品和仪器进行实验(铁架台等固定仪器未画出)。按气流由左向右的方向,仪器连接顺序是 。回答以下问题:
。回答以下问题:
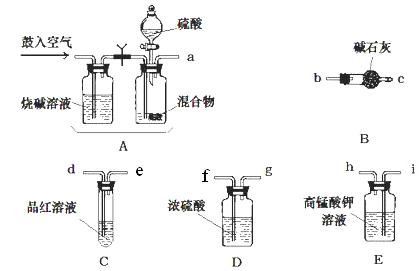
(1)A中加入硫酸溶液的仪器名称是: 。
(2)实验开始,混合物加酸前,A装置需要鼓入空气,排除装置中原有的空气。加酸后A装置再次鼓入空气的作用是 。
(3)E装置的作用是 。
(4)实验中,要确保实验中C瓶溶液不褪色,若C瓶中溶液褪色,则测定结果可能会偏 (填“高”或“低”)。
(5)若混合物样品质量为13.1g,充分作用后碱石灰增重4.4g,则混合物中NH4HCO3的质量分数为 。
(6)从定量测定的准确性考虑,该套装置还应作进一步的改进是 。
(12分)(1)分液漏斗(2分)
(2)将生成的气体全部送入后续装置(使反应产生的SO2和CO2被完全吸收)(2分)
(3)除去SO2,以防止SO2对测定结果的影响(2分)
(4)高 (共2分) (5)60.3%(2分)
(6)在B之后再接一个阻止空气中水蒸气和二氧化碳进入B的装置。(2分)
【解析】
试题分析:(1)根据仪器的构造特点可知,A中加入硫酸溶液的仪器名称是分液漏斗。
(2)加酸后生成CO2和SO2气体,所以加酸后A装置再次鼓入空气的作用是将生成的气体全部送入后续装置(使反应产生的SO2和CO2被完全吸收)。
(3)由于SO2也能碱石灰吸收,会干扰CO2的测定,所以高锰酸钾溶液的作用是除去SO2,以防止SO2对测定结果的影响。
(4)若C瓶中溶液褪色,说明SO没有完全被除尽,也被碱石灰吸收,则测定结果可能会偏高。
(5)碱石灰增重4.4g,则反应中生成的CO2的质量就是4.4g,物质的量是0.1mol。则根据碳原子守恒可知,碳酸氢铵的物质的量也是0.1mol,质量是7.9g,所以混合物中NH4HCO3的质量分数为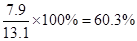 。
。
(6)由于空气中也含有水蒸气和CO2,也能被碱石灰吸收,所以从定量测定的准确性考虑,该套装置还应作进一步的改进是在B之后再接一个阻止空气中水蒸气和二氧化碳进入B的装置。
考点:考查物质含量测定的实验探究、仪器的识别、物质的分离、除杂、误差分析、实验设计与评价以及计算
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,难易适中,在注重对学生基础知识检验与巩固的同时,侧重对学生能力的培养和实验能力的训练与指导。有助于培养学生规范、严谨的实验设计能力,提高学生的综合实验能力,提升学生的学科素养。该类试题重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。

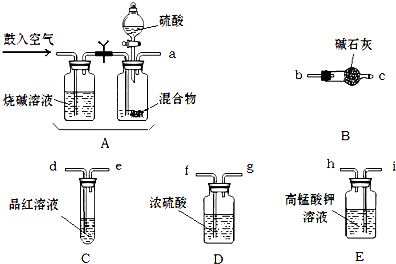
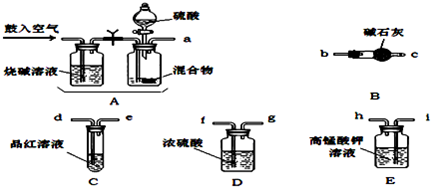
 物中加酸的实验方法来测定其中NH4HCO3的质量分数。(SO2与酸性KMnO4的反应原理:SO2+MnO4-+H+-->SO42-+Mn2++H2O )
物中加酸的实验方法来测定其中NH4HCO3的质量分数。(SO2与酸性KMnO4的反应原理:SO2+MnO4-+H+-->SO42-+Mn2++H2O )