题目内容
(本题共12分)
Ⅰ、氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2) NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g) = N2O4(l) ΔH1=-19.5kJ?mol-1
②N2H4(l) + O2 (g)=N2(g)+2H2O(g) ΔH2 ="-534.2" kJ·mol-1
写出肼和N2O4反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
Ⅱ、一定质量的液态化合物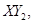 在标准状况下的一定质量的
在标准状况下的一定质量的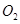 中恰好完全燃烧,反应方程式为:
中恰好完全燃烧,反应方程式为: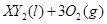 ===
===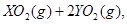 冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56
冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56 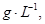 则:
则:
(1)反应前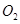 的体积是 。 (2)化合物
的体积是 。 (2)化合物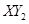 的摩尔质量是 。
的摩尔质量是 。
(3)若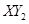 分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为 和 (写元素符号)。
分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为 和 (写元素符号)。
Ⅰ、氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2) NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g) = N2O4(l) ΔH1=-19.5kJ?mol-1
②N2H4(l) + O2 (g)=N2(g)+2H2O(g) ΔH2 ="-534.2" kJ·mol-1
写出肼和N2O4反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
Ⅱ、一定质量的液态化合物
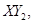 在标准状况下的一定质量的
在标准状况下的一定质量的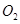 中恰好完全燃烧,反应方程式为:
中恰好完全燃烧,反应方程式为: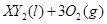 ===
===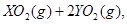 冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56
冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56 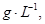 则:
则: (1)反应前
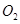 的体积是 。 (2)化合物
的体积是 。 (2)化合物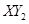 的摩尔质量是 。
的摩尔质量是 。(3)若
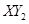 分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为 和 (写元素符号)。
分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为 和 (写元素符号)。I、(1)5 (2)2NH3+NaClO==N2H4+NaCl+H2O
(3)2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △H=-1048.9kJ·mol-1
(4)2N2H4 -4e-+4 OH-==2N2+4H2O
Ⅱ、 (1)672 mL (2)76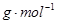 (3)C 、 S
(3)C 、 S
(3)2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △H=-1048.9kJ·mol-1
(4)2N2H4 -4e-+4 OH-==2N2+4H2O
Ⅱ、 (1)672 mL (2)76
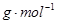 (3)C 、 S
(3)C 、 SI、 (1)N原子的原子结构示意图为: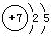 ,故其L层上有5个电子;
,故其L层上有5个电子;
(2)NH3+NaClO——N2H4,根据元素守恒还应生成NaCl和H2O,观察法可配平方程式为 2NH3+NaClO==N2H4+NaCl+H2O;
(3)肼与N2O4反应生成N2和水蒸气:2N2H4 +N2O4==3N2+4H2O,观察已知的两个热方程式可知,②×2-①得:2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △H=△H2×2-△H1="=" -1048.9kJ·mol-1
(4)“肼—空气燃料电池是一种碱性电池”中O2在正极反应,故负极是肼发生反应:2N2H4 -4e-+4 OH-==2N2+4H2O。
Ⅱ、(1)由反应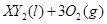 ===
===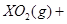
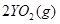 可知,反应前后气体的体积没有发生变化,故V
可知,反应前后气体的体积没有发生变化,故V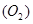 ="672" mL。
="672" mL。
(2)由m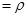 V,生成物的质量m="0.672"
V,生成物的质量m="0.672" 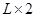 .56
.56 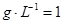 .72 g,
.72 g,
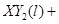
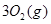 ===
===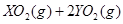
0.01 mol 0.03 mol
所以M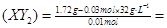 76
76 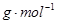
(3)由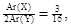 Ar(X)+ 2Ar(Y)=76,得Ar(X)="12," Ar(Y)=32,则X为C,Y为S。
Ar(X)+ 2Ar(Y)=76,得Ar(X)="12," Ar(Y)=32,则X为C,Y为S。
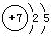 ,故其L层上有5个电子;
,故其L层上有5个电子;(2)NH3+NaClO——N2H4,根据元素守恒还应生成NaCl和H2O,观察法可配平方程式为 2NH3+NaClO==N2H4+NaCl+H2O;
(3)肼与N2O4反应生成N2和水蒸气:2N2H4 +N2O4==3N2+4H2O,观察已知的两个热方程式可知,②×2-①得:2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △H=△H2×2-△H1="=" -1048.9kJ·mol-1
(4)“肼—空气燃料电池是一种碱性电池”中O2在正极反应,故负极是肼发生反应:2N2H4 -4e-+4 OH-==2N2+4H2O。
Ⅱ、(1)由反应
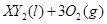 ===
===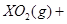
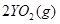 可知,反应前后气体的体积没有发生变化,故V
可知,反应前后气体的体积没有发生变化,故V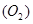 ="672" mL。
="672" mL。(2)由m
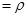 V,生成物的质量m="0.672"
V,生成物的质量m="0.672" 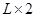 .56
.56 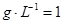 .72 g,
.72 g, 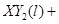
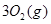 ===
===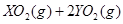
0.01 mol 0.03 mol
所以M
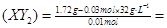 76
76 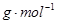
(3)由
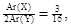 Ar(X)+ 2Ar(Y)=76,得Ar(X)="12," Ar(Y)=32,则X为C,Y为S。
Ar(X)+ 2Ar(Y)=76,得Ar(X)="12," Ar(Y)=32,则X为C,Y为S。
练习册系列答案
相关题目

 CuO
CuO 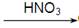 Cu(NO3)2
Cu(NO3)2 CuO
CuO 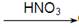 Cu(NO3)2
Cu(NO3)2