题目内容
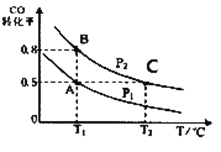
【题目】甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g ) + 2H2( g )CH3OH ( g ) △H=-90.8 kJ·mol-1在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为20 L。
(1)该反应的化学平衡常数表达式为_____________。
(2)图中正反应速率:ν(A)___ν(B);平衡常数: K(A)_____K(C);平均摩尔质量:M(B)_____M(C)(填“>”、“<”或“=”)。
(3)关于反应CO(g)+2H2(g) CH3OH(g)在化学平衡状态时的描述正确的是_______(填字母)。
A.CO的含量保持不变
B.2V正(CH3OH)=V正(H2)
C.容器中CH3OH浓度与CO浓度相等
D.容器中混合气体的密度保持不变
(4)如反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)为__________L。
【答案】 K=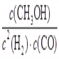 < > > ABD 4
< > > ABD 4
【解析】(1)根据平衡常数的定义可得到该反应的化学平衡常数的表达式为K=![]() ;(2)由图可知,相同温度下P1曲线CO的转化率较小,反应为气体体积缩小的反应,压强越大,转化率越大,则P1<P2,增大压强反应速率增大,则图中正反应速率:ν(A)<ν(B);正反应为放热反应,升高温度平衡常数减小,因T1<T2,故平衡常数: K(A)>K(C);由B点到C点CO的转化率减小,气体的总物质的量增大,质量不变,则气体的平均摩尔质量减小,故有M(B) >M(C);(3) A.CO的含量保持不变,则各组分的物质的量,总物质的量不变,可逆反应达到平衡状态,选项A正确;B. 在任何时刻2V正(CH3OH)=V正(H2),若2V正(CH3OH)=V逆(H2),则V正(H2)=V逆(H2),反应达到平衡,选项B正确; C.容器中CH3OH浓度与CO浓度相等,这只是一个很特殊的情况,这时反应可能达到平衡,也可能未达到平衡状态,选项C错误;D.由于该反应是个反应前后气体体积不等的反应,如果反应未达到平衡,则气体的物质的量就会发生改变,混合气体的平均相对分子质量也就会随着改变。若容器中混合气体的平均相对分子质量保持不变,则气体的物质的量不变。故反应达到平衡状态。选项D正确。答案选ABD;(4)若密闭容器中充入10 mol CO 和20molH2,当达到平衡状态A 时,CO的转化率为0.5,此时各物质的物质的量为CO为5mol;H2为10mol; CH3OH为5mol。n(气体)=20mol,容器的体积为20 L。如反应开始时仍充入10molCO 和20mol H2,在达到平衡状态B时CO的转化率为0.8,则此时各物质的物质的量为CO为2mol,H2为4mol,CH3OH为8mol。n(气体)=14mol。由于A、B是在相同温度下进行的。所以化学平衡常数不变,设第二次达到平衡时容器的体积为V。则
;(2)由图可知,相同温度下P1曲线CO的转化率较小,反应为气体体积缩小的反应,压强越大,转化率越大,则P1<P2,增大压强反应速率增大,则图中正反应速率:ν(A)<ν(B);正反应为放热反应,升高温度平衡常数减小,因T1<T2,故平衡常数: K(A)>K(C);由B点到C点CO的转化率减小,气体的总物质的量增大,质量不变,则气体的平均摩尔质量减小,故有M(B) >M(C);(3) A.CO的含量保持不变,则各组分的物质的量,总物质的量不变,可逆反应达到平衡状态,选项A正确;B. 在任何时刻2V正(CH3OH)=V正(H2),若2V正(CH3OH)=V逆(H2),则V正(H2)=V逆(H2),反应达到平衡,选项B正确; C.容器中CH3OH浓度与CO浓度相等,这只是一个很特殊的情况,这时反应可能达到平衡,也可能未达到平衡状态,选项C错误;D.由于该反应是个反应前后气体体积不等的反应,如果反应未达到平衡,则气体的物质的量就会发生改变,混合气体的平均相对分子质量也就会随着改变。若容器中混合气体的平均相对分子质量保持不变,则气体的物质的量不变。故反应达到平衡状态。选项D正确。答案选ABD;(4)若密闭容器中充入10 mol CO 和20molH2,当达到平衡状态A 时,CO的转化率为0.5,此时各物质的物质的量为CO为5mol;H2为10mol; CH3OH为5mol。n(气体)=20mol,容器的体积为20 L。如反应开始时仍充入10molCO 和20mol H2,在达到平衡状态B时CO的转化率为0.8,则此时各物质的物质的量为CO为2mol,H2为4mol,CH3OH为8mol。n(气体)=14mol。由于A、B是在相同温度下进行的。所以化学平衡常数不变,设第二次达到平衡时容器的体积为V。则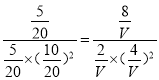 ,解得v=4(L)。
,解得v=4(L)。

【题目】乙苯(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:
C8H10(g) ![]() C8H8(g)+H2(g) ΔH=+125 kJ·mol-1
C8H8(g)+H2(g) ΔH=+125 kJ·mol-1
Ⅰ.某温度下,将0.40 mol乙苯充入1 L真空密闭容器中发生上述反应,测定不同时间该容器内物质的物质的量,得到数据见下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20 min时,该段时间内H2的平均生成速率是__________。
(2)该温度下,反应从开始到平衡的过程中共从环境吸收__________kJ热量。
(3)若保持反应条件不变,用0.40 mol H2(g)和0.40 mol C8H8(g)合成C8H10(g),当有25 kJ热量放出时,该反应中H2的转化率是______,此时该反应的方向是________(填“正向” 或“ 逆向”)。
Ⅱ.氢化热是指在一定条件下,1 mol不饱和化合物加氢时放出的热量,表中是环己烯(g)、1,3-环己二烯(g)和苯的氢化热数据:
物质 |
|
|
|
氢化热(kJ/mol) | 119.7 | 232.7 | 208.4 |
(4)1,3-环己二烯的稳定性________(填“大于”“小于”或“等于”)苯。
(5)某有机物是苯的同分异构体,其分子中的碳碳键角只有60度和90度两种。请写出这种有机物的键线式结构________,它在核磁共振氢谱上会产生________个吸收峰 。
(6)与环己烯互为同分异构体的炔烃共有________种(不考虑立体异构)。